【上海精瑞科學(xué)儀器有限公司 為 BIAseparations中國總代理 正規(guī)授權(quán) 售后無憂】一家專業(yè)提供HPLC色譜柱、GC色譜柱、SPE前處理小柱和其他實(shí)驗(yàn)室常用耗材、配件的公司,同時(shí)提供各種進(jìn)口標(biāo)準(zhǔn)品和各類分析儀器
歡迎咨詢:
156 0189 2007 馮女士(VX同號)
QQ:3295336257
-BIA Separations!讓病毒純化更高效
前面 blabla 說了那么多,然而純化才是本工藝的精華所在。
BIA Separations 的二步純化工藝的穩(wěn)健性、連貫性、時(shí)效性,均堪稱教科書式的經(jīng)典。
首先純化的柱子,通過弱陰離子交換,濃縮 pDNA 并去除大部分 HCP、mRNA 和基因組 DNA;
第二步利用疏水相互作用色譜(HIC)的拋光步驟,進(jìn)一步從超螺旋(SC)治療級 pDNA 中除去開環(huán)(OC)和線性 pDNA 亞型。
兩步純化的作用功能明確、互相合作,大大節(jié)省操作步驟和時(shí)間。
??????? AEX 色譜柱(CIMmultus™DEAE)濃縮 pDNA,并去除大部分 HCP、mRNA 和基因組 DNA。
??????? 在弱陰離子交換柱上捕獲質(zhì)粒 DNA,其中除去剩余的 RNA 和蛋白質(zhì),樣品結(jié)合需要低電導(dǎo)率,通過稀釋實(shí)現(xiàn)。
??????? 隨著增加 NaCl 的梯度洗脫,首先洗脫 RNA,然后洗脫質(zhì)粒 DNA。
層析條件
Monolithic column: | CIMmultus™ DEAE(2 µm)*1 |
phase: | Equilibration buffer A1: 50 mM Tris, 10 mM EDTA, pH 7.2 |
Washing buffer A2: 50 mM Tris, 10 mM EDTA, 0.6 M NaCl, pH 7.2 | |
Elution buffer A3: 50 mM Tris, 10 mM EDTA, 1 M NaCl, pH 7.2 | |
Working flow rates: | 0.5 – 5 column volume (CV) /min (具體取決于樣品特性,使用的層析設(shè)備和色譜柱尺寸) |
*1 選擇色譜柱體積,取決于需要處理的樣品量。
層析方法
1. 用去離子水稀釋細(xì)菌裂解物至電導(dǎo)率為 35-40mS / cm。稀釋取決于樣品制備過程中添加的 CaCl2 濃度。
2. 將稀釋的樣品用 0.45μm 過濾器進(jìn)行過濾。
3. 將 20CV 的緩沖液 A1 平衡 DEAE 柱。
4. 將澄清的稀釋細(xì)菌裂解液進(jìn)行上樣。
5. 用 20 CV 的緩沖液 A1 對色譜柱進(jìn)行流洗。
6. 用 20 CV 的緩沖液 A2 對色譜柱進(jìn)行流洗。
7. 用 20 CV 的緩沖液 A3(以半工作流速)洗脫并收集 pDNA。
圖 1:AEX CIMmultus™DEAE(2μm)柱上的質(zhì)粒 DNA 洗脫曲線
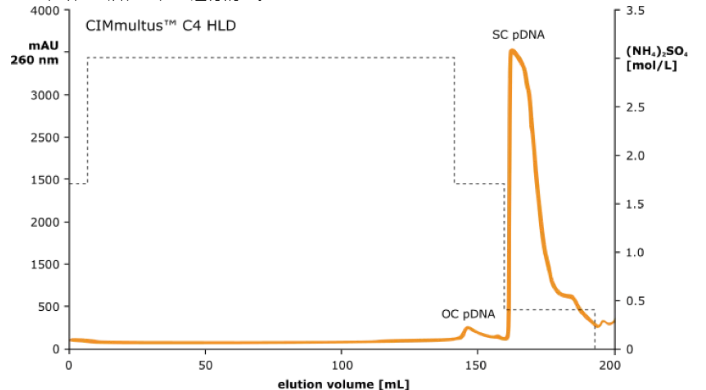
??????? 在高配體密度丁基修飾的(CIMmultus TM C4 HLD)整體柱上,利用疏水相互作用色譜柱(HIC)的拋光步驟,進(jìn)一步從 超螺旋(SC)治療級 pDNA 中除去開環(huán)(OC)和線性 pDNA 亞型。
??????? ??????? 為了富集質(zhì)粒 DNA 的超螺旋亞型,將 DEAE 洗脫液上樣到高配體密度丁基柱(C4 HLD)上。
??????? ??????? 該步驟進(jìn)一步去除了雜質(zhì)。
層析條件
phase: | Equilibration buffer B0: 50 mM Tris, 10 mM EDTA, 3 M (NH4)2SO4, pH 7.2 |
Washing buffer B1: 50 mM Tris, 10 mM EDTA, 1.7 M (NH4)2SO4, pH 7.2 | |
Adjustment buffer: 4 M (NH4)2SO4 | |
Elution buffer B2: 50 mM Tris, 10 mM EDTA, 0.4 M (NH4)2SO4 , pH 7.2 | |
Regeneration buffer A1: 50 mM Tris, 10 mM EDTA, pH 7.2 | |
Working flow rates: | 0.5 – 5 CV/min (具體取決于樣品特性、使用的層析設(shè)備和色譜柱尺寸) |
*2 選擇色譜柱體積,取決于需要處理的樣品量。
層析方法
1. 調(diào)節(jié)來自 DEAE 柱的含 pDNA 洗脫液,每 1 體積(V)洗脫液加入 3 體積(V)的 4M(NH4)2SO4。
2. 用 20CV 的緩沖液 B0 來平衡 C4 HLD 柱。
3. 將 DEAE 柱洗脫的 pDNA 組份上樣。
4. 用 20 CV 的緩沖液 B1 流洗色譜柱。
5. 用緩沖液 B2(以半工作流速)洗脫并收集 pDNA。
6. 用 30 CV 的緩沖液 A1 再生色譜柱。
7. 加樣 3 次后,對柱子進(jìn)行清洗。
圖 2:在 HIC CIMmultus TM C4 HLD(2μm)柱上分離超螺旋質(zhì)粒 DNA
· 從 C4 HLD 柱洗脫的超螺旋 pDNA 組份含有硫酸銨,必須在生物應(yīng)用質(zhì)粒之前將其除去。
· 緩沖液交換可通過透析濾過或體積排除色譜等方法進(jìn)行。
· 配置和填充可能需要額外的處理。
二步法層析過程分析:
??????? 質(zhì)粒 DNA 制造成功的關(guān)鍵是實(shí)時(shí)過程控制方法,確保最終產(chǎn)品中高百分比的超螺旋 pDNA。
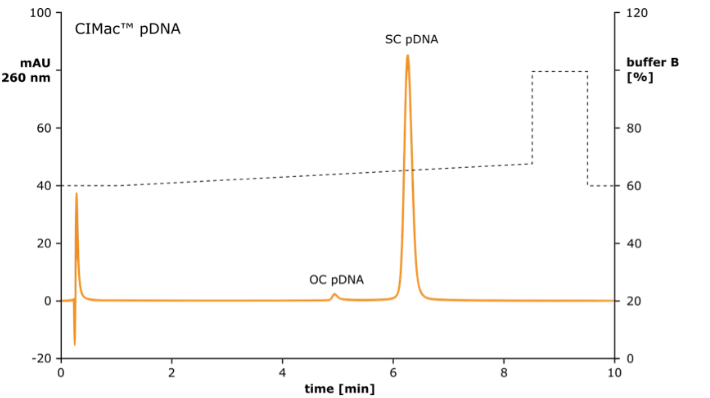
?????????? CIMac™pDNA 分析柱可用于監(jiān)測降解產(chǎn)物(開環(huán)和線性 pDNA),去除雜質(zhì)(RNA),并確保每個(gè)生產(chǎn)步驟都能產(chǎn)生預(yù)期的超螺旋 pDNA 量。
??????? ???????CIMac™pDNA 分析柱還用于超螺旋質(zhì)粒 DNA 含量的質(zhì)量控制。
圖 3:使用 CIMac™pDNA-0.3 分析柱的質(zhì)粒 DNA 亞型含量的質(zhì)量控制
結(jié)果和結(jié)論:
??????? ????? 通過優(yōu)化裂解、沉淀和兩種色譜步驟相結(jié)合,可生產(chǎn)滿足所有監(jiān)管要求的純 pDNA。
??????? ??????? 可以完成去除 99% 以上的主要雜質(zhì)(RNA,基因組 DNA,宿主細(xì)胞蛋白,內(nèi)毒素和開環(huán) pDNA)。
??????? ??????? 此外,快速(大腸桿菌的 pDNA 提取和純化可在幾小時(shí)內(nèi)完成),可重復(fù)的過程可降低運(yùn)營成本并提高工廠生產(chǎn)率。
??????? ??????? *的整體特性有助于該過程的直接可擴(kuò)展性,涵蓋從小規(guī)模實(shí)驗(yàn)室到大規(guī)模工業(yè)純化 pDNA 的生產(chǎn)水平。
Table 1: Process results.
Process yield | > 80 % |
A260/280 | 1.92 |
Homogeneity (SC pDNA) | > 97 % |
HCD – removed | > 99.5 % |
HCP - removed | > 99 % |
Endotoxin | < 2 EU/mg pDNA |
RNA - removed | > 99 % |
點(diǎn)評
目前市面上有不少質(zhì)粒純化工藝方案,但是比較下來,BIA 二步法純化工藝具有兩大優(yōu)勢:
??????? 效率明顯提高
只需兩步色譜和高流速的整體柱色譜方案,減少工藝步驟(提高回收率)并加快純化速度,從而顯著提高生產(chǎn)率。
??????? 靈活放大
由于特定的整體柱設(shè)計(jì),質(zhì)粒 DNA 過程可以快速擴(kuò)展到更大的單位。
在 1 毫升色譜柱上設(shè)計(jì)的工藝可以輕松轉(zhuǎn)移到試驗(yàn)和生產(chǎn)規(guī)模。
在 8L 色譜柱上單次運(yùn)行可以產(chǎn)生 48 g 藥物級 scDNA。
Table 2: Scale up options.
Column size | pDNA purified per cycle |
1 mL | 6 mg |
8 mL | 48 mg |
80 mL | 480 mg |
800 ml | 4.8 g |
8000 mL | 48 g |
十多年來,BIA Separations 一直是高效率質(zhì)粒純化的好選擇。它不僅提供整體柱和平臺模板,還提供定制的純化服務(wù),以*您的質(zhì)粒 DNA 純化需求
159 0176 2218(VX同號)









 ??????? AEX 色譜柱(CIMmultus™DEAE)濃縮 pDNA,并去除大部分 HCP、mRNA 和基因組 DNA。
??????? AEX 色譜柱(CIMmultus™DEAE)濃縮 pDNA,并去除大部分 HCP、mRNA 和基因組 DNA。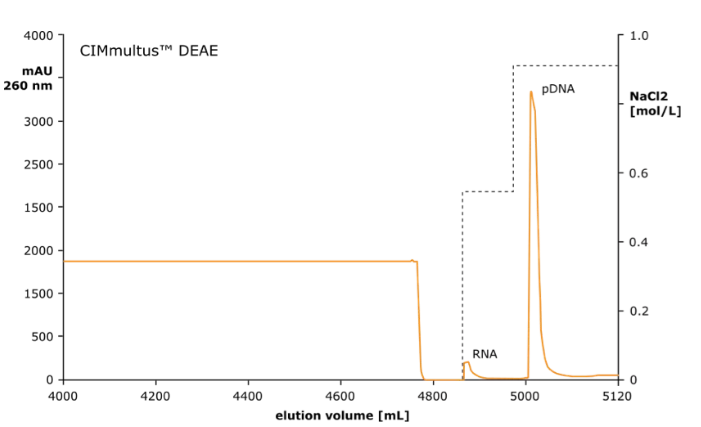


 ??????? 效率明顯提高
??????? 效率明顯提高

 化工儀器網(wǎng)
化工儀器網(wǎng)