介孔二氧化硅納米顆粒-藥物控釋/介孔氧化硅磁性納米-磁靶向(MSNs)
西安凱新生物科技有限公司是國內的無機納米顆粒和藥物 蛋白納米載體生產銷售公司,我公司提供一種介孔二氧化硅納米顆粒或微球 介孔孔徑是2納米-50納米之間 可以用來裝載藥物或其他分子。
西安凱新生物科技有公司是國內的藥物靶向和藥物傳遞試劑生產銷售商,我公司除了傳統的脂質體納米載藥,近些年還新上了許多納米類材料,比如有介孔納米材料包括有介孔二氧化硅顆粒,介孔二氧化硅包裹的磁性納米顆粒,介孔聚苯乙烯熒光微球,介孔熒光性聚膦腈納米等等產品,這些材料表面還可以修飾氨基或羧基等不同活性基團,用于修飾各種藥物及抗體或DNA等等。
供應商:西安凱新生物科技有限公司
請點擊此處西安凱新生物科技有限公司進入展臺查看
請點擊此處西安凱新生物科技有限公司進入展臺查看
1:介孔二氧化硅顆粒介紹(mesoporous silica nanoparticles, MSNs)
單分散介孔氧化硅納米顆粒(mesoporoussilica nanoparticles, MSNs),具有粒徑分布均一、水分散性良好、超高的比表面積、較窄的孔徑分布和大孔容積等優點,生物相容性良好。可作為熒光分子、化療藥物、DNA/siRNA、蛋白等各類客體分子的優良載體,用以診斷、治療等生物醫學應用。
介空二氧化硅微球 mesoporous silica nanoparticles, MSNs
粒徑200/220/250/280/300納米
固含量:5mg/ml
比表面積:500㎡/g
孔容積:0.5平方厘米/g
產品:
mesoporous silica nanoparticles 100nm
mesoporous silica nanoparticles 200nm
mesoporous silica nanoparticles 250nm
mesoporous silica nanoparticles 280nm
mesoporous silica nanoparticles-amine 100nm
mesoporous silica nanoparticles-amine 200nm
mesoporous silica nanoparticles-amine 250nm
mesoporous silica nanoparticles-amine 280nm
mesoporous silica nanoparticles-acid 100nm
mesoporous silica nanoparticles-acid 200nm
mesoporous silica nanoparticles-acid 250nm
mesoporous silica nanoparticles-acid 280nm
單分散磁性介孔氧化硅納米顆粒(magneticmesoporous silica nanoparticles, M-MSNs),是以超順磁性徑Fe3O4納米顆粒作為內核,介孔氧化硅作為包覆層的復合納米顆粒。具有磁核表面介孔層生長均勻完整、復合顆粒粒徑分布均一、水分散性良好、超高的比表面積、較窄的孔徑分布和大孔容積等優點,生物相容性良好。內部的小粒徑Fe3O4納米核具有超順磁性,可作為T2造影劑進行MRI成像,亦可在外磁場作用下產生磁熱療效應;外部包覆的介孔氧化硅殼層可裝載熒光分子、化療藥物、DNA/siRNA、蛋白等各類客體分子,M-MSNs是具有巨大應用前景的診療一體化納米顆粒平臺。
介孔二氧化硅包裹的磁性納米顆粒magnetic mesoporous silica nanoparticles, M-MSNs
固含量:5mg/ml
平均粒徑:50 ±10 nm
磁核粒徑:12 ± 3 nm
比表面積:>500m2/g
孔容積:>0.5cm3/g
產品:
magnetic mesoporous silica nanoparticles,M-MSNs 50 ±10 nm
magnetic mesoporous silica nanoparticles-amine 50 ±10 nm
magnetic mesoporous silica nanoparticles-acid 50 ±10 nm
magnetic mesoporous silica nanoparticles-OH 50 ±10 nm
magnetic mesoporous silica nanoparticles-FITC 50 ±10 nm
通過對介孔二氧化硅納米粒子(MSN)載藥機理、藥物控釋機理(PH響應、光響應、溫度響應、酶響應及競爭性結合響應)、靶向方法(配體靶向、磁靶向、量子點應用于靶向)的介紹,對 MSN 在可控藥物傳輸系統中的應用加以綜述。
介孔二氧化硅納米粒子; 藥物傳輸; 控制釋放; 靶向;量子點。
近年來,介孔材料由于其*的優異性能成為了研究開發的熱點,在催化、吸附分離、藥物釋放等領域的應用前景更使其備受關注。1992年,Kresge等,在Nature雜志上報道了一類以硅鋁酸鹽為基的新穎的介孔氧化硅材料,M41S,其中以命名為MCM-41的材料引人注目其特點是孔道大小均勻 、六方有序排列、孔徑在1。5-10nm 范圍可以連續調節,具有高的比表面積和較好的熱穩定及水熱穩定性,從而將分子篩的規則孔徑從微孔范圍拓展到介孔領域 這對于在沸石分子篩中難以完成的大分子催化 、吸附與分離等過程 ,無疑展示了廣闊的應用前景。
可控藥物傳輸系統可以實現藥物在病灶部位的靶向釋放,有利于提高藥效,降低藥物的毒副作用,在疾病治療和醫療保健等方面具有誘人的應用潛力和廣闊的應用前景,已成為藥劑學、生命科學、醫學、材料學等眾多學科研究的熱點[1-6]。許多藥物都具有較高的細胞毒性,在殺死病毒細胞的同時,也會嚴重損傷人體正常細胞。因此,理想的可控藥物傳輸系統不僅應具有良好的生物相容性,較高的載藥率和包封率,良好的細胞或組織特異性——即靶向性;還應具有在達到目標病灶部位之前不釋放藥物分子,到達病灶部位后才以適當的速度釋放出藥物分子的特性。
介孔SiO2納米粒子(mesoporoussilica nanoparticles,MSN)具有在2~50 nm范圍內可連續調節的均一介孔孔徑、規則的孔道、穩定的骨架結構、易于修飾的內外表面和無生理毒性等特點,非常適合用作藥物分子的載體。同時,MSN 具有巨大的比表面積(>900 m2/g)和比孔容(>0。9 cm3/g),可以在孔道內負載各種藥物,并可對藥物起到緩釋作用,提高藥效的持久性。因此,近年來 MSN 在可控藥物傳輸系統方面的應用日益得到重視,本文通過對 MSN 載藥機理[7]、藥物控釋機理[8]和靶向方法[9-14]的介紹,對 MSN 在可控藥物傳輸系統中的應用[15-17]加以綜述。
1、介孔二氧化硅納米顆粒
1992年,Kresge等合成出MCM-41型介孔分子篩,這種具有規則孔道結構的介孔納米微球立即吸引了廣泛的關注,并得到了快速的發展。MSN是利用有機分子(表面活性劑或兩親性嵌段聚合物)作為模板劑,與無機硅源進行界面反應,形成由二氧化硅包裹的規則有序的組裝體,通過煅燒或溶劑萃取法除去模板劑后,保留下二氧化硅無機骨架,從而形成的多孔納米結構材料。通過選擇不同的模板劑和采用不同的合成方法可得到不同結構特征的介孔材料。
1。1 MSN的生物相容性
MSN 要在可控藥物傳輸系統中取得實際應用,首先要考慮的一個問題就是其生物相容性。Lin 課題組研究了MSN對動物細胞的生存能力和繁殖能力的影響, 結果表明當 MSN 濃度低于每 105個細胞 100 μg/mL 時,細胞的生存能力和繁殖能力基本不受影響,即使在第 7 個細胞周期也是如此,他們還通過選擇性DNA染色結合流式細胞儀分析,發現細胞吸收MSN后仍舊保留了完整的細胞膜,顯微鏡觀察可以看到細胞形態正常,3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴鹽比色法(MTT)測試結果表明線粒體活性仍然處于正常水平,雖然 MSN 的長期生物相容性與生物降解性還沒有得到深入的研究,但近的一篇報道顯示,硅膠植入動物體內后,在長達 42 d 內未顯示任何毒副作用。因此可以認為,MSN 具有良好的生物相容性,可以用作藥物載體。
1。2 MSN的細胞內吞
Hoekstra 等研究發現非噬菌類真核細胞可以內吞尺寸達 500 nm 的乳膠粒子,內吞效率隨著粒子尺寸的減小而增加, 當粒子尺寸在 200nm 左右或更小時吸收效率高,但未觀察到粒徑大于1 µm的粒子的吸收。 MSN 具有在 50~300 nm 范圍內可調的粒徑,這使得MSN 可以通過內吞方式進入細胞,有效地將藥物輸送到細胞內。
細胞吸收通常是靠被吸收物質與細胞膜結合受體(如低密度脂蛋白或轉鐵蛋白受體)之間的特定結合力來實現的。但是沒有相應受體的物質,仍能通過細胞內吞或胞飲作用而被吸收。MSN與磷脂之間有較強的親和力,可以通過這種高親和力吸附在細胞表面,進而發生細胞內吞。體外細胞試驗結果表明 MSN 可以有效地被各種哺乳動物細胞內吞,如癌細胞(HeLa, CHO, lung, PANC-1)、非癌細胞(神經膠質、肝、內皮)、小噬細胞、干細胞(3TL3,間葉細胞)等 MSN 的內吞過程(如圖1所示)非常快,通常引入MSN 30 min后,即可在細胞內觀察到被內吞的MSN。
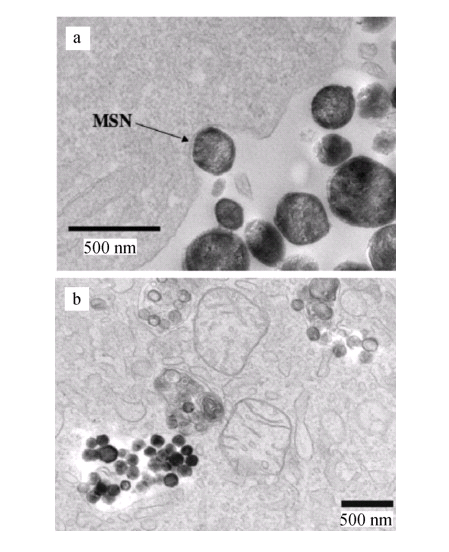
圖1 HeLa 細胞內吞 MSN 的TEM照片
為了弄清細胞內吞 MSN 的機制,科學家們做了更進一步的研究。 Mou 等研究了3T3L1 和間葉干細胞內吞熒光標記的 MSN 的過程, 發現其內吞作用是通過網格蛋白介導的途徑進行的,并且粒子能夠逃脫內溶酶體囊泡。用不同官能團修飾 MSN 的外表面,還可以控制MSN的吸收效率和吸收機制,Lin等發現用特定基團(如葉酸)修飾 MSN 的外表面,可以顯著提高 MSN 的細胞吸收效率; 用帶電荷的官能團修飾 MSN 的外表面,能夠提高吸收效率,增強粒子逃脫內溶酶體的能力。上述實驗結果表明,外表面的官能化對 MSN 進入細胞的途徑有很大影響。目前,大多數人認為網格蛋白介導的內吞作用是非官能化MSN 和絕大多數官能化 MSN 進入細胞的主要途徑,而葉酸改性的 MSN 則是通過葉酸受體介導的內吞作用進入細胞,胺和胍基官能化的MSN 則可能是通過一種與網格蛋白和細胞質膜微囊無關的內吞機制進入細胞。
2、 MSN藥物傳輸系統的藥物負載
作為載藥系統的納米微粒可分為以下 6 種類型:微乳、生物可降解高分子納米粒、脂質體、固體脂質納米粒、磁性納米粒和基因轉導的納米顆粒。它們各有特點適于不同制劑的開發,例如,微乳作為載藥系統,可以增加難溶性藥物的溶解度,提高水溶性藥物的穩定性,提高藥物的生物利用度,同時具有藥物的緩釋性和靶向性,并且適于工業化制備。微乳具有高擴散性和皮膚滲透性,使其在透皮吸收制劑的研究方面得到極大關注。生物可降解納米顆粒可以改變藥物的體內分布,具有控釋性和靶向性,增加藥物的穩定性,提高藥物的生物利用度,特別適用于多肽和蛋白質等基因工程藥物口服劑型的研究。脂質體載藥系統同樣具有藥物的緩釋性和靶向性,增加藥物在體內和體外的穩定性,降低藥物毒性,提高藥物治療指數,特別是脂質體結構的可修飾性,使開發具有特殊功能的載藥系統如隱形脂質體、免疫脂質體成為可能。固體脂質納米粒的顯著特點:一是采用生理相容性好的低毒類脂材料為載體;二是可采用已成熟的高壓乳勻法進行工業化生產,同時固體脂質納米粒載藥系統還具有控釋性、靶向性、較高的載藥量及改善藥物的穩定性等優點。磁性納米粒載藥系統,可以通過外加磁場將藥物導向靶位,適用于潛表部位病灶或外加磁場易觸及部位病灶的診斷和治療。納米載體介導的遺傳物質能地進入靶細胞,并且不易被血漿或組織細胞中各種酶所破壞。因此基因能透過核膜進入細胞核,并整合于染色體 DNA 中,從而獲得轉基因的穩定表達而發揮治療作用。
載藥過程通常是將載體浸泡在高濃度的藥物溶液中,然后分離、干燥。載體對藥物的吸附能力決定了載藥能力。MSN的孔徑大小決定了能夠進入孔道內的藥物分子的大小,因此,MSN 的藥物吸附主要由粒子的孔徑大小決定。一般情況下,只要 MSN 的孔徑稍大于藥物分子的尺寸(即孔徑/藥物尺寸>1)就足以將藥物吸附到孔內。MSN吸附藥物的能力主要來源于介孔表面與藥物之間的氫鍵作用、離子鍵相互作用、靜電相互作用和疏水性相互作用等。MSN的比表面積和比孔容對載藥量的影響很大,在孔徑允許的情況下, 比表面積越大吸附藥物的量也就越大。Vallet-Regi等研究了兩種比表面積不同的MSN(MCM-41和SBA-15,比表面積分別為 1157 和 719 m2/g)負載藥物阿侖膦酸的情況,發現它們的大載藥量分別為 139 和 83 mg/g。藥物與介孔表面的相互作用是負載藥物的主要推動力,然而,在載藥過程中還可能產生藥物與藥物之間的弱相互作用,這種作用將導致藥物將整個介孔填滿,從而使得載藥率大大提高。因此,比孔容也是決定藥物負載量的一個關鍵因素。Azais 等發現連續幾次負載藥物可以有效地提高 MSN 的大載藥量,這是由于藥物分子間的弱相互作用可以使介孔得到大限度的填充,因此, 大的比孔容可以產生更大的載藥量。
3、 MSN藥物傳輸系統的藥物控釋
對于藥物傳輸系統來說,藥物的釋放往往是更重要的環節。藥物釋放可分為不可控釋放和可控釋放兩種,兩者的區別在于:在不可控釋放情況下,藥物傳輸系統進入介質后,即開始釋放藥物,藥物的釋放地點和速度不可控制;在可控釋放情況下,可以有目的性地控制藥物的釋放地點和速度。隨著科技的發展和人們對治療水平要求的提高,藥物傳輸系統逐漸由不可控釋放向可控釋放發展。在早期的 MSN 藥物傳輸系統研究中,主要是通過改變 MSN 的結構參數,如孔徑、比表面積和比孔容來實現對藥物的控制釋放。隨著研究的深入,基于環境響應性的藥物控釋逐漸成為研究的熱點。
3。1 基于MSN 結構參數的藥物控釋
早期的 MSN 藥物傳輸系統主要利用材料的高比表面積和比孔容來負載藥物,藥物僅簡單地吸附在介孔內,主要靠孔徑或孔的形態來實現藥物的控制釋放。。2001 年,Vallet-Regi 等研究了兩種不同孔徑的MCM-41型MSN對藥物布洛芬(IBU)的負載情況,并研究了其在模擬體液中的釋放行為,研究結果表明MCM-41 具有較高的載藥量,可以延長藥物的釋放周期,并且隨著孔徑的增大,藥物的釋放速率加快。孔徑可以控制藥物的動力學釋放過程,這一概念不僅適用于 2 維六方孔道結構的 MCM-41,對于具有3維六方孔道結構的MCM-48介孔材料也同樣適用此后,這方面的工作陸續展開,曲鳳玉等將藥物Captopril 和 IBU 分別負載于 MCM-41 的孔道中; Andersson 等將 IBU 負載于 SBA 系列的介孔材料中。這些研究發現藥物的釋放速率不僅與孔徑有關,還與介孔的其它性質有關,如孔的連通性、幾何形態等。
Lin 等研究了 MSN 的孔和粒子形態對藥物控釋性能的影響, 他們使用了一種特殊的模板劑室溫離子液體(room-temperature ionic liquid, RTIL),以這種模板劑合成出相應體系的MSN (RTIL-MSN)來研究抗菌劑的控釋。他們制備了一系列具有不同粒子形態的RTIL-MSN材料,包括球形、橢圓形、棒狀和管狀。通過改變 RTIL 模板可以得到不同形態的孔道結構,例如MCM-41 型的六方孔道、Moiré 型螺旋孔道、蠕蟲狀孔道。這種孔內封裝離子液體的MSN, 其控釋能力可通過測量它們對大腸桿菌 K12 的抗菌效果來研究。結果顯示,具有球形、六方孔道的RTIL-MSN與管狀、蟲洞狀孔道的RTIL-MSN相比具有更好的抗菌活性。這一結果可以歸因于平行六方孔道與無序的蟲洞孔道相比,從前者擴散釋放出RTIL的速率更快。這項工作表明了MSN的形態對控釋行為的重要性。通過改變 MSN 表面性質的方法來控制藥物的釋放有兩種不同的方法:改變 MSN 的比表面積;或通過表面官能化的方法在表面修飾一些小分子以改變藥物與表面之間的作用力。MSN 表面具有豐富的硅羥基,可以通過硅烷偶聯劑修飾上不同的官能團,因此對 MSN 進行表面官能化修飾是常用的改變MSN表面性質的方法,圖 2總結了常用的修飾官能團和相對應使用的藥物。 Vallet-Regi等研究發現不同官能團修飾的MCM-41對藥物布洛芬吸附和釋放的性能有很大影響,這主要是因為修飾的官能團與藥物的特定基團之間會產生氫鍵、靜電或疏水性等相互作用所引起的。Zhu, Song, Zeng等分別采用3-氨丙基三乙氧基硅烷(APS)后修飾方法和一步法制備了氨基修飾的 MSN,并用不同藥物對修飾后的 MSN 的載藥和釋藥行為進行了研究。結果發現氨基修飾能顯著提高 MSN 的載藥率, 延長釋放周期;并且發現一步法對延長水溶性藥物 BSA 和阿司匹林的釋放周期較好,而 APS 后修飾法對延長非水溶性藥物 IBU 的釋放周期較好。 Tang 等用羧基化的 MSU型MSN 負載藥物法莫替丁, 法莫替丁分子中的氨基可與羧基產生電荷相互作用,從而實現藥物的有效負載,研究發現修飾的羧基量是影響載藥量的關鍵因素,體外實驗表明該載藥系統緩釋效果明顯。Sousa 等用膠原質修飾SBA-15型MSN,膠原質能夠對藥物阿替洛爾的釋放起到阻礙作用,緩釋效果更加明顯。上述結果說明,可以選擇性的對 MSN 表面進行功能化,修飾不同的官能團,從而實現對不同藥物的負載和控制釋放。
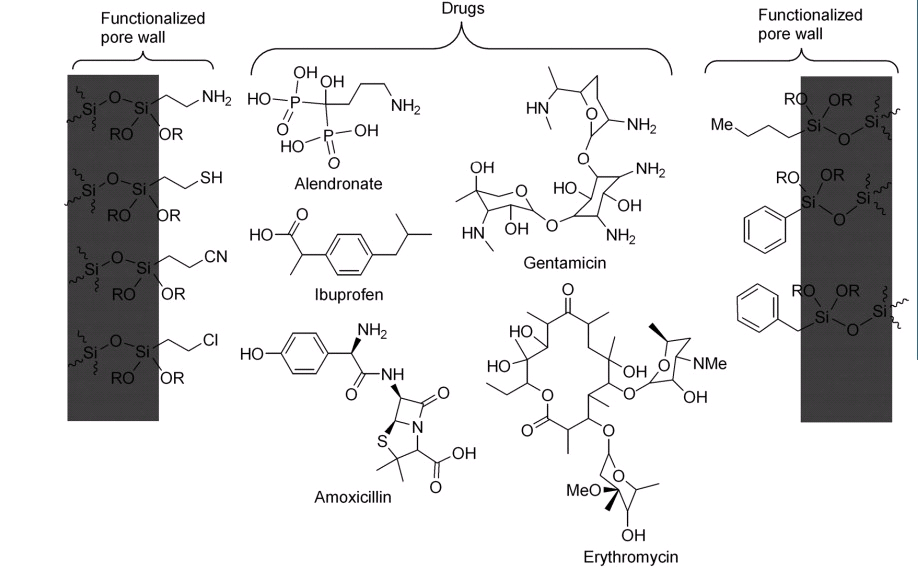
圖2 常用的MSN 表面官能化基團和在這些體系中使用的一些藥物的結構
3。2 基于刺激響應性的藥物控釋
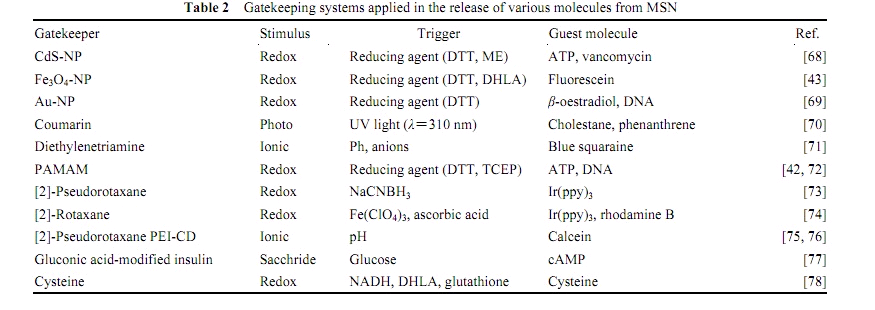
在使用一些具有較強細胞毒性的藥物時,常常要求在到達病灶部位之前做到藥物“零釋放”,以減小藥物的毒副作用。而早期的藥物傳輸系統都不具備這一特點,都還僅僅停留在緩釋階段。2003 年, Lin 等創造性地設計合成了以 MSN 為基礎的刺激響應性藥物傳輸系統,真正實現了對藥物的控釋。此后,這類藥物傳輸系統得到了深入的發展,表 1 總結了目前為止發表的以MSN 為基礎的這種可控藥物傳輸系統。這些系統利用各種化學實體(如納米粒子、有機分子、超分子組裝體)作為“門衛”(gatekeepers),在一定外界環境(如光、pH、 還原劑等)的刺激下發生反應,從而實現對藥物分子的控制釋放。
表1 具有“門衛”的 MSN 類刺激響應性體系
腫瘤組織的溫度比正常組織稍高,pH 比正常組織稍低,并且不同組織所處的 pH 環境也不同。因此, 在“門衛”型藥物控釋傳輸系統盛行的同時,具有 pH和熱響應型的藥物控釋傳輸系統也成為了人們研究的熱點。
3。2。1基于介孔二氧化硅的pH響應用于藥物控釋[18]
R Casasus等利用(EtO)3SiCH2CH2CH2(NHCH2CH2)NH2在MCM-41的外出口處引人了pH敏感開關,其作用機理如圖3所示。在低pH值的水溶液中,MCM-41外表面碳鏈上的氨基被質子化,在靜電排斥的作用下,碳鏈分開將閥門關閉;在高pH值的水溶液中,凝膠外表面碳鏈上的氨基被去質子化,在氫鍵和疏水作用下,含氨基的碳鏈聚集在一起使閥門打開。靠控制溶液的pH值可控制閥門的*開關及開關程度,從而進行有效的可控釋放[10]。
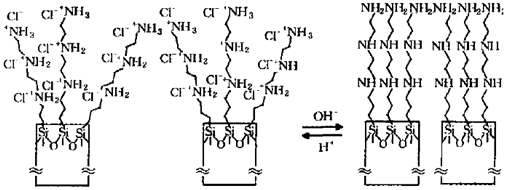
圖3 基于MCM-41的用于可控釋放的pH敏感開關示意圖
3。2。2基于介孔二氧化硅的光響應用于藥物控釋[19]
利用有機衍生的金納米顆粒(PR-AuNPs)封閉介孔二氧化硅(MSN)孔道,并且在PR-AuNPs上修飾一個光敏元件(photoresponsive linker)TUNA,通光特定的激發光來控制介孔二氧化硅孔道的打開,以應用于對藥物釋放的控制,如圖4所示:
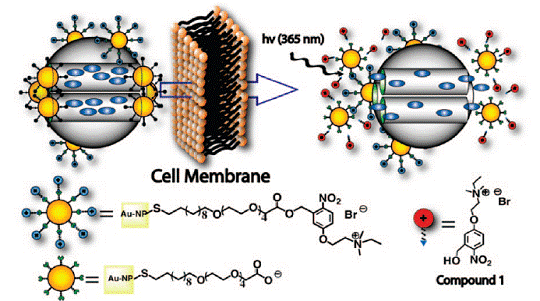
圖4。PR-AuNPs-MSN控制藥物釋放原理圖
3。2。3基于介孔二氧化硅的溫度響應用于藥物控釋
當溫度小于LCST時,布洛芬和介孔材料形成氫鍵而被捕獲,當溫度大于LCST時,布洛芬和介孔材料形成氫鍵被打斷,從而釋放到顆粒外面。腫瘤組織的溫度比正常組織稍高,利用這種載體結構可能能實現抗腫瘤藥物的可控和靶向釋放。
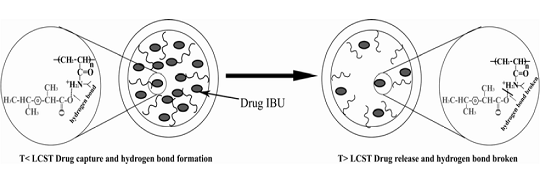
圖5。 溫度響應型納米復合材料MCF-PNIPA控制釋放機理圖
3。2。4基于介孔二氧化硅的酶響應用于藥物控釋[20]
豬肝酯酶催化起塞子作用的酯水解,從而致使β-CD脫離,進而孔內的藥物得以釋放。如圖6示:
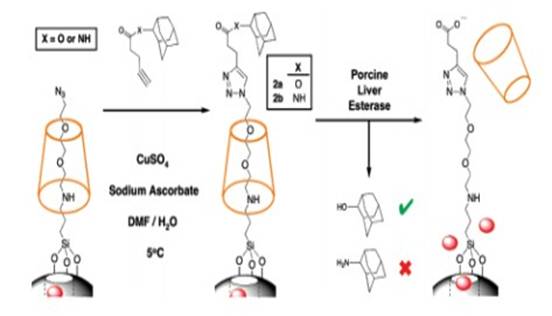
圖6。Synthesis and Activation of Enzyme Responsive Snap-Top System
3。2。5基于介孔二氧化硅的競爭性結合響應用于藥物控釋[21]
連接有多孔MCM-41二氧化硅納米顆粒的DB24C8超納米分子,當金屬陽離子與其發生競爭性結合時,超納米分子與二氧化硅顆粒的結合被打破,從載體上脫落,從而孔內的藥物釋放出來。如圖7示:
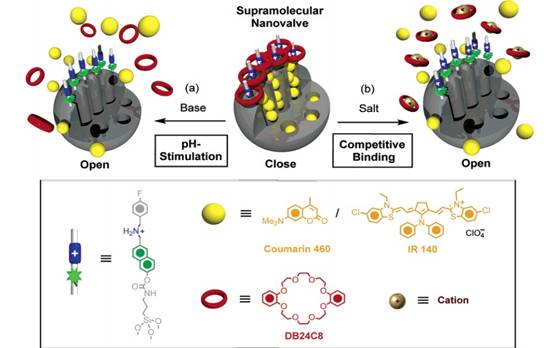
圖7。 競爭性結合開關的作用原理示意圖
4、 MSN藥物傳輸系統的靶向功能
理想的藥物傳輸系統,不僅要具備良好的控釋能力,而且要具備能將藥物準確地輸送到病灶部位的能力。在惡性腫瘤治療中, 這一點顯得尤為重要,準確的靶向不僅可以提高藥物的治療效果, 還可以大大減小藥物對正常細胞和組織的毒副作用。 目前,對于具有靶向功能的藥物傳輸系統的研究主要集中在配體靶向和磁靶向方面。配體靶向是指利用抗體或特定配體的細胞靶向,它依賴于靶向劑與細胞表面抗體的選擇性結合,從而引起受體介導的細胞內吞。葉酸是目前研究得比較廣泛和深入的配體靶向,這是由于絕大多數的癌細胞表面其葉酸受體均表達過度,如卵巢、子宮內膜、直腸、乳腺、肺、腎、神經內分泌癌、源于上皮癌的腦異位癌等。 Rosenholm 等用超支化聚乙烯亞胺(PEI)修飾MSN的外表面,再利用MSN表面的氨基修飾熒光分子FITC 和葉酸配體,得到了一種同時具有標記和靶向功能的藥物傳輸系統,幾種不同葉酸受體表達水平的細胞對粒子的內吞實驗結果顯示,葉酸受體表達多的癌細胞,其粒子內吞數量是正常細胞的五倍多。
4。1 配體靶向給藥
在腫瘤治療的過程中,為降低藥物的不良反應,提高藥效,尋找有效的藥物靶向傳遞系統已成為腫瘤生物治療的研究熱點之一。隨著細胞分子生物學的不斷發展,在腫瘤細胞表面或腫瘤相關血管發現了一系列受體,其在腫瘤組織過度表達并與腫瘤生長增殖密切相關。以腫瘤細胞表面特異性或過度表達的受體為靶點,利用受體和配體的特異性反應,將配體與藥物結合,配體發揮導向物作用,將藥物靶向遞送到腫瘤細胞 (或組織),實現主動靶向釋藥,可以提高特定部位的藥物濃度。引入能被病灶靶細胞特異識別的*配體的藥物傳遞系統 ,稱之為配體靶向藥物傳遞系統 ( ligand2 drug delivery system,LDDS)。LDDS將藥物運輸到細胞表面 ,導向配體與細胞表面表達的受體識別和相互作用,受體介導內吞釋放藥物,從而特異性地殺傷腫瘤細胞,這種在腫瘤治療中以細胞表面受體為靶點的配體靶向治療引起人們的廣泛關注。
4。2 磁靶向給藥
磁靶向藥物傳輸系統(Magnetic targeted drugs de-livery system, MTDDS)是近幾年發展起來的一種新型靶向藥物傳輸系統。磁性粒子和 MSN 結合的形式一般分兩種: 一種是以磁性粒子為核,介孔二氧化硅為殼;另一種是磁性粒子通過一定的化學作用吸附到MSN表面。Wu 等首先合成了一種以微米級 Fe3O4 為核,介孔二氧化硅為殼的具有核-殼結構的磁性MSN復合粒子,開啟了磁性粒子與介孔二氧化硅結合的熱潮。Giri 等制備了一種用超順磁性氧化鐵納米粒子封孔的介孔二氧化硅納米棒,該體系中氧化鐵粒子不僅起到藥物靶向的作用,還充當控制藥物釋放的“門衛”。 Liong 等以氧化鐵晶體為核,介孔二氧化硅為殼,并繼續在外表面修飾上一層親水的磷酸根、葉酸配體和熒光分子,得到的載藥系統在靶向能力提高的同時,還具有熒光成像的功能。
4。3量子點用于靶向藥物開發治療
傳統的熒光分子染料作為標記試劑,每種試劑需要特定的偶聯方法,而用量子點作標記物對生物大分子標本的活性無傷害,且與生物大分子的偶聯方法比較單一。因此利用量子點實現靶向藥物開發治療成為了研究熱點。
量子點是一種新型小分子熒光染料[22-24],又稱為半導體納米微晶體,是一種三維尺寸都限制在納米級單位內的新型熒光材料,通常為核殼結構,其核心為具有高發光效率的半導體物質,外包一層硫化物。該結構提高了量子的化學性能和光學性能[25],使其在醫學領域有著廣闊的應用前景。
通過溶膠凝膠法制備得到磁性介孔二氧化硅球,增加模板劑C18TMS的量,介孔硅球的比表面積隨之增。加對介孔微球表面進行巰基功能化修飾后,利用介孔二氧化硅球表面的巰基對不同粒徑的CdTe量子點進行吸附,比較了介孔二氧化硅球的熒光發射譜與純量子點的熒光發射譜。當量子點尺寸較小時,介孔球的熒光發射峰與量子點的熒光發射峰相差不大;當量子點的平均尺寸略大于可幾孔徑時,只有較小粒徑部分的量子點能夠進入到介孔二氧化硅球中,所以熒光發射峰向短波長方向移動;當量子點的尺寸遠大于介孔的孔徑時,量子點無法進入到介孔球中,就無法觀察到相應的熒光發射譜。因此,以量子點為碼尺,通過介孔微球對不同尺寸的量子點的吸附可以對介孔球的孔徑大小進行近似估計。將量子點看作模型藥物,則介孔微球對相當尺寸的小分子藥物能實現裝載,結合介孔微球的磁響應,這類介孔微球可望用做磁靶向給藥系統。
5、總結與展望
MSN 以其*的性能,在生物醫藥等領域顯示出了誘人的應用前景,必將會給臨床治療手段和藥物治療帶來突飛猛進的進步。目前, 關于MSN 類藥物傳輸系統的研究越來越多,不管在控制 MSN 的形態、穩定性和分散性上,還是設計新穎的靶向、控釋藥物輸送體系上, 都取得了巨大的成就。人們不再滿足于合成單一功能的 MSN 藥物傳輸系統,逐漸向制備集成像、靶向、多重環境相應性控釋為一體的多功能復合微球轉移,如引入量子點或熒光分子使微球具有成像和跟蹤標記功能,引入磁性粒子使微球具有磁分離、靶向和共振的功能。
雖然 MSN 藥物傳輸系統已經取得了許多成績,顯示了其在未來應用中的潛力。但要想進一步取得實際應用,仍有許多問題需解決。 例如,MSN材料的體內研究仍未深入展開,關于材料在血液中的流通性能、可能引發的免疫反應、在肝臟或某些組織中是否有可能發生積聚等重要問題仍有待于探索;MSN 材料在體內的長期生物相容性有待于深入研究;基于 MSN 藥物傳輸系統的藥物控制釋放仍有待于擴展和深入研究。盡管還存在許多問題,但我們相信,會有更多新的合成方法和巧妙的設計產生,賦予 MSN 更多的功能,來一一解決這些問題。這些問題的解決也將推動 MSN藥物傳輸系統一步一步走向實際應用。











