巴氏吸管由醫用級聚乙烯(PE)制成,管體
堿基編輯器研究進展
在廣泛使用的CRISPR/Cas9基因編輯工具中,核酸酶Cas9含有兩個具有切割活性的結構域:HNH結構域和RuvC結構域,其中HNH結構域切割與crRNA互補的DNA鏈,而RuvC結構域切割非互補鏈。RuvC結構域可分為三個亞結構域:RuvC I、RuvC II和RuvC III,RuvC I接近于Cas9的氨基端,RuvC II和RuvC III位于HNH結構域的兩側。僅對Cas9中的RuvC I進行突變,具體而言就是讓RuvC I的兩個關鍵氨基酸殘基中的一個轉換成丙氨酸(D10A或H840A),從而得到Cas9切口酶(Cas9 nickase, Cas9n)。這種切口酶不能切割非互補DNA鏈,僅能切割與crRNA互補的DNA鏈。如果同時讓Cas9中的這兩個結構域發生突變,便可得到僅對DNA有結合活性但沒有切割活性的dCas9(nuclease-dead Cas9,沒有核酸酶切割活性的Cas9)。
CRISPR/Cas9是由一種原始的細菌免疫系統改編而成的,它的作用方式是首先在基因組的一個靶位點上切割雙鏈DNA。相比之下,堿基編輯并不切割DNA雙螺旋,而是在組成DNA或RNA的四個堿基中,利用酶地重新排列其中的一個堿基上的一些原子,從而將這個堿基轉化為一個不同的堿基,同時不改變其周圍的堿基。這種能力大大增加了改變遺傳物質的選擇手段。2017年,通過堿基編輯器編輯技單個堿基技術入選2017年《科學》雜志“科學突破”。
1.Nat Med:堿基編輯器取得重大進展!有望在產前治療先天性疾病
doi:10.1038/s41591-018-0184-6; doi:10.1038/s41591-018-0215-3
來自美國費城兒童醫院和賓夕法尼亞大學佩雷爾曼醫學院的研究人員進行產前基因編輯來阻止實驗室動物出現致命性的代謝障礙,從而有潛力在出生前治療人類先天性疾病。這就為在產前利用一種復雜的低毒的工具地對致病性基因中的DNA堿基進行編輯提供了概念驗證。相關研究結果發表在2018年10月的Nature Medicine期刊上,論文標題為“In utero CRISPR-mediated therapeutic editing of metabolic genes”。論文通信作者為賓夕法尼亞大學佩雷爾曼醫學院的Kiran Musunuru博士 和William H. Peranteau博士。
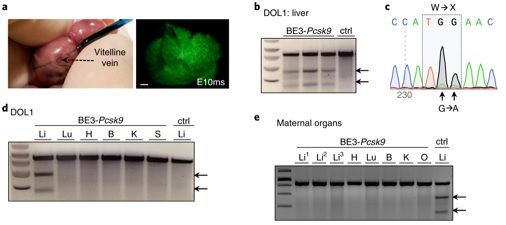
圖片來自Nature Medicine, doi:10.1038/s41591-018-0184-6。
這些研究人員使用了基因編輯工具CRISPR-Cas9和第三代堿基編輯器(base editor 3, BE3)靶向編輯一種調節膽固醇水平的基因,從而降低了在子宮內接受過這種治療的健康小鼠中的膽固醇水平。他們還在一小部分事先經過基因改造而攜帶著導致一種致命性肝臟疾病---1型遺傳性酪氨酸血癥(hereditary tyrosinemia type 1, HT1)---的突變的小鼠中使用產前基因編輯來改善它們的肝臟功能和阻止新生小鼠死亡。
2.Nat Med:在體內利用新型堿基編輯器有望治療遺傳疾病
doi:10.1038/s41591-018-0209-1; doi:10.1038/s41591-018-0215-3
苯丙酮尿癥(phenylketonuria)的病因是編碼苯丙氨酸羥化酶(phenylalanine hydroxylase, Pah)的基因發生突變。這種由肝細胞產生的酶代謝苯丙氨酸。這種代謝障礙是一種“常染色體隱性”遺傳疾病:兒童如果從母親那里遺傳一個突變基因拷貝和從父親那里遺傳一個突變基因拷貝,那么就會患上這種疾病。到目前為止,這種疾病仍然是無法治愈的。
在一項研究中,來自瑞士蘇黎世聯邦理工學院和蘇黎世大學的研究人員利用一種方法糾正肝細胞中的兩個突變基因拷貝,從而治愈這種疾病。他們在小鼠體內取得了成功,。相關研究結果發表在2018年10月的Nature Medicine期刊上,論文標題為“Treatment of a metabolic liver disease by in vivo genome base editing in adult mice”。論文通信作者為蘇黎世聯邦理工學院的Gerald Schwank教授。
這種由胞苷脫氨酶(cytidine deaminase)加以強化的CRISPR/Cas9系統結合到這兩個需要被校正的基因拷貝上,并且在局部打開DNA雙鏈。胞苷脫氨酶將致病性的DNA堿基對C-G轉化為健康人體內對應基因組位點上存在的堿基對T-A。這能夠校正Pah酶編碼基因中的DNA堿基錯誤。通過這種方法,這些研究人員改變了成年小鼠中這兩個突變基因拷貝中的堿基序列。這些經過校正的肝細胞能夠產生功能性的Pah酶,這些小鼠所患的這種疾病被治愈了。
3.Cell子刊:我國科學家成功利用堿基編輯修復人胚胎中的致病性基因突變
doi:10.1016/j.ymthe.2018.08.007
來自中國廣州醫科大學附屬第三醫院、中科院生物化學與細胞生物學研究所和上海科技大學的研究人員利用一種改進形式的CRISPR基因編輯技術來修復活的人胚胎中的遺傳缺陷。在近期發表Molecular Therapy期刊上的標題為“Correction of the Marfan Syndrome Pathogenic FBN1 Mutation by Base Editing in Human Cells and Heterozygous Embryos”的論文中,描述了他們的研究工作和取得的進展。論文通信作者為廣州醫科大學附屬第三醫院生殖醫學中心的劉見橋(Jianqiao Liu)教授和中科院生物化學與細胞生物學研究所的黃行許(Xingxu Huang)教授。
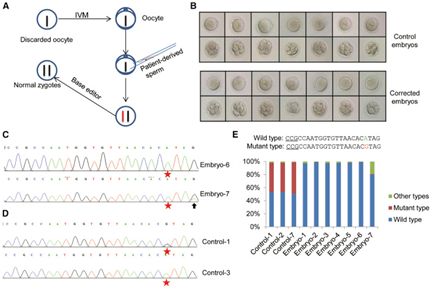
圖片來自Molecular Therapy, doi:10.1016/j.ymthe.2018.08.007。
在三年前,一個中國研究團隊利用CRISPR對人胚胎進行編輯。該團隊試圖利用這項技術修復人胚胎中的遺傳缺陷。雖然這在當時成為世界各地的頭條新聞,但是它的成功率很低---在經過這種技術編輯后存活下來的54個胚胎中,僅4個胚胎攜帶著成功得到修復的基 因。從那時起,人們就開發出一種新的被稱作堿基編輯的CRISPR變體,它以更有效的方式發揮作用。這種新方法不會切斷DNA鏈和利用攜帶著所需特征的DNA片段替換移除的DNA片段,而是僅僅改變DNA堿基---比如利用堿基G替換堿基A。在這項新的研究中,這些研究人員使 用這種新方法來校正導致人類患有馬凡綜合癥(Marfan syndrome)的基因突變,在這種疾病中,患者在FBN1基因上發生G→A突變。這是一種導致結締組織問題的疾病,而且給那些出生時就攜帶這種突變的人帶來無數的問題。
他們對18個胚胎進行了基因編輯,并且在所有的這些胚胎中,事先設計好的堿基變換按照計劃發生。但是,在兩個胚胎中,其他的堿基也在無意中發生變換。他們聲稱他們的研究為這種堿基編輯技術提供概念驗證---在現實世界的體外受精診所中,有缺 陷的胚胎經發現后會被丟棄。然而,他們確實承認這個領域仍然是非常新的,而且在嘗試將這種技術用于允許發育成胎兒的胚胎中之前,還需開展更多的研究工作。
4.兩篇Protein & Cell報道我國科學家進一步優化腺嘌呤堿基編輯系統
doi:10.1007/s13238-018-0568-x; doi:10.1007/s13238-018-0566-z
來自中國華東師范大學和中山大學的兩個研究小組在小鼠和大鼠品系中開發出一種被稱作腺嘌呤堿基編輯器(adenine base editor, ABE)的堿基編輯系統,并對這種系統加以改進,這將對人類遺傳疾病和基因療法帶來重大的影響。相關研究結果發 表在開放存取的Protein & Cell期刊上,論文標題分別為“Increasing targeting scope of adenosine base editors in mouse and rat embryos through fusion of TadA deaminase with Cas9 variants”和“Effective and precise adenine base editing in mouse zygotes”。
人基因由堿基A、T、C和G組成,這些堿基以特定的順序排列在一起來編碼遺傳信息。這種ABE系統能夠產生所需的A→G轉化,因而允許科學家們改變遺傳密碼,同時讓不想要的結果zui小化。鑒于幾乎一半的人類遺傳疾病是由C/G→T/C突變引起的,這是通過ABE系統加 以校正,因此它是一種有前景的治療應用技術。
在這兩項新的研究中,這些研究人員利用這種ABE系統地培育出三種小鼠品系來模擬一種被稱作杜氏肌營養不良(Dunchenne Muscular Dystrophy, DMD)的遺傳性肌肉變性疾病。他們還使用一種大鼠模型來模擬II型遺傳性糖原貯積病。這些模型可能是測試創新療法 (特別是基因療法)的重要資源。
5.重磅!Nature和Science同日打擂臺發表新型DNA/RNA堿基編輯器,可校正點突變
doi:10.1126/science.aaq0180; doi:10.1038/nature24644
自從5年前CRISPR熱潮開始以來,科學家們就競相開發這種強大工具的更加全面或的版本,從而能夠極大地簡化DNA編輯。本周發表在Science期刊和Nature期刊上的兩項研究進一步擴大了CRISPR的使用范圍,開發出一種更加微妙的被稱作堿基編輯(base editing)的方法來修復遺傳物質:一項研究擴展了一種編輯DNA的策略,而另一項研究通過對RNA進行堿基編輯而開辟了新的領域。
大量借用CRISPR工具包的堿基編輯系統很容易在非分裂細胞(nondividing cells)中實現堿基編輯。DNA具有4個核苷酸堿基:A、C、T和G,堿基編輯會將一個堿基改變為另一個堿基。在Liu的2016年那項研究中,他的團隊將gRNA與一個“死的”Cas9(dCas9)融合在一起,dCas9不能夠切割整個DNA雙螺旋,但是仍然能夠在正確的位點上讓它解鏈。這些研究人員將酶APOBEC1附著到gRNA-dCas9上,這會觸發一系列化學反應,終導致堿基C改變為堿基T。DNA的堿基配對規則控制著隨后的堿基變化。這種配對規則規定一條DNA鏈上的T與另一條DNA鏈上的A配對。dCas9經進一步修飾后在未編輯的DNA鏈上產生切口,從而激活細胞的DNA修復機制,將初始與堿基C配對的堿基G轉化為與這個新產生的T配對的A。
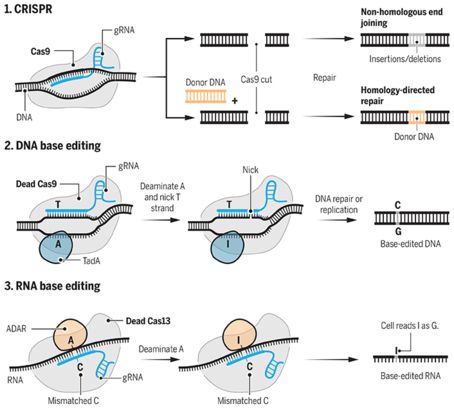
圖片來自 C. BICKEL/SCIENCE; (DATA) D. B. T. COX ET AL., SCIENCE 358, 6362, 2017;J. DOUDNA AND E. CHARPENTIER, SCIENCE 346, 6213, 2014; GAUDELLI ET AL., NATURE 551, 7677, 2017。
這個DNA堿基編輯器并不能夠解決與人類疾病相關的為常見的點突變(大約占一半):在應當為G•C的地方存在著A•T。如今,來自Liu團隊的這個新的編輯器能夠修復這種點突變。該團隊再次將gRNA與dCas9融合在一起,但是已知沒有一種能夠將A轉化為G的酶。因此,他們利用來自大腸桿菌的酶TadA開出一種新型酶。這種新型酶將A轉化為一種被稱作肌苷(inosine, I)的堿基。隨后不論是一種細胞修復機制,還是DNA自我復制過程,都會將I變成G。美國哈佛大學CRISPR研究員George Church說,“在這項研究中,重要的事情是對TadA酶進行基因改造讓它具備某種非天然的功能。”
張鋒團隊通過將gRNA與一種不同的沒有切割活性的核酸酶dCas13和一種將RNA中的A轉化為I的天然性酶融合在一起而構建出一種RNA堿基編輯器。與DNA中不同的是,這不會導致隨后的堿基變化。含I的RNA僅像那個位點上存在一個G那樣發揮作用。
6.Nat Biotechnol:在人全基因組水平上證實基于CRISPR的單堿基校正是準確的
doi:10.1038/nbt.3852
來自韓國基礎科學研究所(Institute for Basic Science, IBS)基因組工程中心的研究人員證實了一種近期開發的基因編輯方法的準確性。這種基因編輯工具起著“DNA剪刀”的作用,旨在鑒定和替換人基因組(大小為30億個堿基對)中的僅一個核苷酸(或者說堿基)。這是在全基因組水平上驗證了這種“堿基編輯器(base editor)”的準確性。這種驗證將有助擴大這種方法在農業、牲畜和基因療法中的應用。相關研究結果于2017年4月10日在線發表在Nature Biotechnology期刊上,論文標題為“Genome-wide target specificities of CRISPR RNA-guided programmable deaminases”。論文通信作者為來自IBS基因組工程中心的Seuk-Min Ryu和Jin-Soo Kim。
為了鑒定這種方法的可靠性,Kim團隊對一種被稱作Digenome-seq的錯誤校驗技術進行改進,以便讓它適用于這種堿基編輯器方法。去年,當該團隊分析了CRISPR-Cpf1和CRISPR-Cas9的準確性時,他們就使用和驗證了Digenome-seq。他們也改進了計算機程序Digenome 2.0以便更加全面地鑒定脫靶位點,并且通過比較不同的gRNA發現降低脫靶編輯和增加特異性的gRNA。
7.Nat Biotechnol:利用CRISPR培育出單核苷酸編輯轉基因小鼠
doi:10.1038/nbt.3816
人類DNA由大約30億個核苷酸組成。在某些情形下,僅一個核苷酸發生變化就能夠導致嚴重的疾病。科學家們希望利用一個正確的核苷酸替換這個不正確的核苷酸,從而治愈這些疾病。然而,利用當前的基因編輯工具CRISPR-Cas9替換單個核苷酸存在技術上的挑戰。如今,在一項新的研究中,來自韓國基礎科學研究所(Institute for Basic Science, IBS)基因組工程中心的研究人員利用這種流行的基因編輯技術CRISPR-Cas9的一種變體版本培育出單核苷酸編輯小鼠。相關研究結果于2017年2月27日在線發表在Nature Biotechnology期刊上,論文標題為“Highly efficient RNA-guided base editing in mouse embryos”。
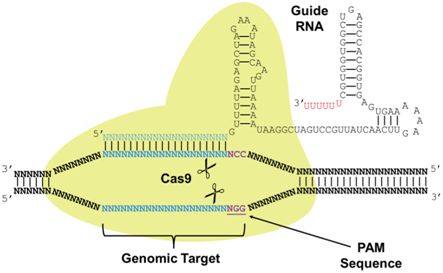
作為近年來出現的一種卓有成效的基因編輯技術,CRISPR-Cas9的作用機制是在DNA雙鏈中的一個發生突變的核苷酸附近進行切割,切除一小段DNA序列。相反,IBS研究人員采用Cas9蛋白的一種變體:切口酶Cas9(nickase Cas9, nCas9),同時讓Cas9與一種被稱作胞苷脫氨酶(cytidine deaminase, CD)的蛋白融合在一起。CRISPR-nCas9-CD能夠將一種核苷酸替換另一種核苷酸,因而也被稱作堿基編輯器(Base Editor)。2016年,美國哈佛大學的David Liu團隊和日本神戶大學的Keiji Nishda團隊已開發出這種類型的脫氨酶,并且在體外培養的細胞系中進行過測試。IBS研究人員通過將這種技術用于小鼠胚胎中,進一步推動它的發展。
IBS研究人員在小鼠體內測試了CRISPR-nCas9-CD是否能夠校正Dmd基因(編碼抗肌萎縮蛋白)或Tyr基因(編碼酪氨酸酶)中的單個核苷酸。他們在這兩種基因中都取得成功:由Dmd基因發生單核苷酸突變的胚胎發育而成的小鼠在它們的肌肉中不產生抗肌萎縮蛋白(dystrophin),而Tyr基因發生單核苷酸突變的小鼠表現出白化性狀。抗肌萎縮蛋白確實與肌肉肌營養不良疾病相關聯,而酪氨酸酶控制黑色素產生。
8.Science:利用改進的CRISPR/Cas9系統和特異性地實現單堿基突變
doi:10.1126/science.aaf8729
利用一種引入DNA單個核苷酸變化的脫氨酶,來自日本神戶大學的研究人員構建出一種改進的CRISPR/Cas9工具,從而避免產生有害的雙鏈斷裂,使得利用CRISPR/Cas9技術引入的附帶突變小化,而且也不需要加入DNA模板。相關研究結果于2016年8月4日在線發表在Science期刊上,論文標題為“Targeted nucleotide editing using hybrid prokaryotic and vertebrate adaptive immune systems”。
為了構建一種更加準確的編輯工具,Kondo和他的同事們將一種沒有核酸酶活性的不能夠切割雙鏈DNA的Cas9版本或一種產生單鏈切口的切口酶Cas9版本與一種來自七鰓鰻(sea lamprey)免疫系統的激活誘導性胞苷脫氨酶(activation-induced cytidine deaminase, AID)融合在一起。在正常情形下,這種AID酶在免疫球蛋白和抗體基因中產生突變從而讓免疫系統具有多樣性。AID作用在單鏈DNA上,將胞嘧啶(C)替換為尿嘧啶(U),隨后在一輪DNA復制中,這種尿嘧啶(U)被轉化為胸腺嘧啶(T)。
通過測試這種新的雜合復合物是否能夠在出芽酵母---缺乏一種內源性的類似AID的系統---中修飾一種選擇性的標志物,Kondo團隊發現當在向導RNA(gRNA)的引導下,這種蛋白復合物靶向作用于CAN1基因,而且相對于非靶向的選擇性標志物,CAN1基因發生突變的頻率增加了1000倍。利用全基因組測序,研究人員發現很少的脫靶突變,只比背景突變率略有增加。論文作者、Kondo實驗室博士后研究員Keiji Nishida說,“[在AID存在下],這種脫靶突變率是可以接受的,相比于自然的背景突變率增加了不到10倍。”(生物谷 )
 您好, 歡迎來到化工儀器網
您好, 歡迎來到化工儀器網

 11
11


