巴氏吸管由醫用級聚乙烯(PE)制成,管體
Science:Treg細胞,細胞療法的下一個風口
在過去的十年中,效應T細胞被設計為表達高度特異性的嵌合抗原受體(CAR)或識別腫瘤抗原的特異性T細胞受體(TCR),這些已經被證明是的過繼細胞療法(ACTs),因此*改變了某些癌癥的治療方式。

個CAR-T藥物獲批,Carl H June成為亮眼的英雄(圖中,圖片來源:pennmedicine)
2017年,兩種CAR-T細胞療法被美國FDA批準用于治療各種CD19 陽性的B細胞淋巴瘤。目前科學家們正在進行廣泛的臨床試驗,以將治療擴展到多種實體腫瘤。
今天在這里,我們來推測下一代非癌癥疾病的免疫細胞療法趨勢
具體而言,我們重點介紹了使用調節性T細胞(Tregs)治療自身免疫性疾病(包括1型糖尿病(T1D),類風濕性關節炎,炎癥性腸病(IBD),移植物抗宿主病),以及可能發生在骨髓移植和器官yi植排斥后的GvHD。同時調節性T細胞還可能用于治療非免疫性疾病,比如阿爾茨海默病,帕金森病,心臟病和2型糖尿病等。
雖然Tregs僅占外周血淋巴細胞的1%至2%,但它們是自我耐受的主要控制者(免疫細胞可以識別外來物質并忽略自身組織,從而避免自身免疫),在組織炎癥和長期免疫穩態過程中起到主要作用。
Treg細胞在免疫平衡中扮演的角色(圖片來源:sec)
在嚴重的Treg缺乏癥中,IPEX(免疫調節,多內分泌病,腸病,X連鎖)綜合征特別突出,關鍵Treg譜系特異性轉錄因子FOXP3(叉頭盒P3)中的突變導致Treg缺陷,導致致命的多器官炎癥和自身免疫。
重要的是,Tregs的數量和/或功能的減少與許多常見自身免疫疾病的病理學有關。實際上,在一些疾病環境中,Treg功能缺陷或Treg生長和存活因子如白細胞介素-2(IL-2)的減少,再加部組織環境中高濃度炎性細胞因子如IL-6,IL-12,IL-1的產生讓Treg不穩定,從而導致不受控制的炎癥和過度的組織損傷。
因此,許多正在進行的研究正在開始重新利用之前獲批的藥物,如Treg生長因子(例如,IL-2)和Treg穩定因子(例如,雷帕霉素),以增強Treg功能的藥物,這些可以作為控制各種自身免疫疾病,GvHD和器官yi植排斥反應的方法。上述這些結果強調了通過增強Treg活性直接改變病理性免疫應答的機會 ,這也是基于Treg的ACT目標。
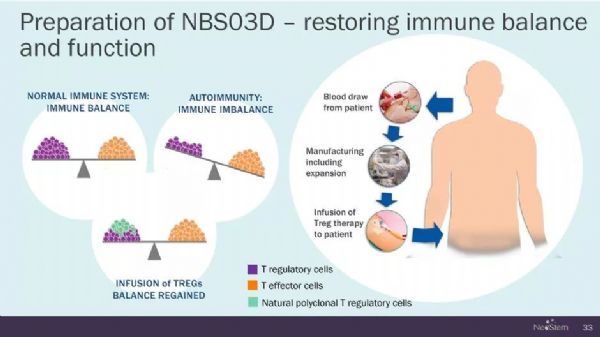
用于治療自身免疫疾病的個臨床前概念驗證研究是使用多克隆的調節性T細胞(Tregs)進行的,他們稱為抑制性細胞,這些細胞基于包括CD4,CD25和CD62L在內的多種細胞表面標志物表達分離出來的。這些努力以及隨后使用純化的FOXP3 + Tregs的研究獲得成功,促進了在多種疾病環境中進行的若干臨床試驗,包括器官yi植排斥,GvHD,T1D和自身免疫綜合征。

優化人類Treg免疫療法的新方法(圖片來源:resources.rndsystems)
從每個患者的外周血中純化細胞,在CD3和CD28抗體的存在下離體生長,伴隨高劑量的IL-2,可以擴增到高度富集的Treg群體,并且在充分表征后,過繼轉移至患者體內,這種多克隆Treg ACT已被證明在1期研究中是安全的。 其中適應癥T1D的第二階段的臨床研究的初步結果預計在2019年(NCT02691247)公開。其他在GvHD適應癥上的療效努力仍在進行中(例如,NCT01795573和NCT01937468)。
此外,越來越清楚的是,諸如心血管疾病,肥胖癥,2型糖尿病,肌肉與腦的退行性疾病等非免疫性疾病因炎癥而惡化。在臨床前研究中積累的證據表明,通過在受損組織(包括流感感染的肺,受肌肉營養不良影響的肌肉)中產生表皮生長因子受體(EGFR)配體雙調蛋白,Tregs可以通過促進組織穩態和修復來平息炎癥并降低這些疾病的發病率。
與多發性硬化癥(MS)相關的神經脫髓鞘,高脂肪飲食誘導的肥胖,肌萎縮側索硬化的一項臨床試驗報道,Treg ACT可能會減少疾病進展。此外,Tregs已被證明可增加骨髓移植的成功率,減少對基因治療的免疫反應,并促進傷口愈合。
那么多克隆的Tregs有效的地方在哪里呢?
臨床前數據顯示,多克隆Treg在控制某些疾病(如狼瘡腎病和IBD)方面是有效的,而在T1D和MS等其他疾病中則更為有效。例如,特異性表達胰島抗原的Treg在阻斷T1D進展方面的效率比多克隆Treg有效50至100倍。由于Tregs具有偏向自身抗原的TCR譜系,我們推測Treg譜系中較大部分TCR可識別具有豐富且多樣化抗原的皮膚和腸道等大組織,而不是胰島等較小組織。
因此,較大的組織可以在多克隆群體中激活足夠的Treg以實現治療效果,而較小的組織將需要針對ACT的抗原特異性Treg細胞。
多克隆Treg的使用可通過轉移大量具有廣泛不確定特異性的Tregs來潛在地抑制針對腫瘤和感染性疾病的保護性免疫。因此,開發抗原特異性Treg療法可能會提供更有效和更安全的替代療法。
重要的是,在多個臨床前模型中,離體選擇的對有限組織抗原或甚至單個抗原具有特異性的Treg可以介導不同特異性的效應T細胞的局部顯性旁觀者抑制。這種富集靶組織特異性Tregs的概念已經被轉化為早期臨床試驗。
從器官yi植受體中分離出Tregs,并用供體器官來源的抗原呈遞細胞(APC)刺激,以選擇性地擴增供體特異性Treg。這些特異性Treg細胞在人源化小鼠移植模型中驗證發現比多克隆Treg更有效抑制器官排斥。這些同種異體抗原反應性Treg正在進行測試以防止在若干臨床試驗中的排斥反應,其目的是減少甚至*撤掉免疫抑制藥物(例如,NCT 02474199)。
對移植抗原以外的組織抗原 應用選擇性擴增方法更具挑戰性
這是因為同種抗原反應性Treg的頻率高達10%,而組織抗原特異性Treg的頻率低幾個數量級。此外,體外反復刺激Tregs可使Tregs不穩定并導致非Tregs的生長。工程化抗原特異性受體(CAR和TCR)的表達是癌癥免疫療法中的成功策略,提供了實現治療性Treg的抗原特異性的解決方案。
在供體組織上對人白細胞抗原A2具有反應性的同種異體抗原特異性CAR可以預防人源化小鼠模型中的同種異體移植排斥反應。
類似地,表達對自身抗原(例如血友病中的因子IX,MS中的髓鞘少突膠質細胞糖蛋白以及T1D中的胰島特異性抗原)特異性轉基因TCR的工程化Tregs細胞,在臨床前模型中顯示出增強的功效。
此外,已經開發出新的方法,使Tregs能夠“分化”以選擇性地控制由T細胞亞群介導的疾病,包括T輔助細胞1(TH1)樣Tregs治療T1D和器官yi植排斥,TH2樣Tregs治療哮喘和過敏,和TH17樣的Tregs治療MS。抗原受體基因工程技術與分化方法的組合將Tregs引導至疾病活動的特定位置或將獲得更穩健和有效的治療效果。
在這方面Tregs的兩個特征值得強調
首先,與必須直接與靶細胞結合的殺死癌細胞的T細胞不同,在許多情況下,不需要治療性Treg直接接觸效應T細胞以抑制功能。 Treg介導的免疫抑制和耐受通常通過改變引流淋巴結和受影響組織中的局部組織微環境而發生。

治療性Treg作用的部位:在發生原發性免疫的淋巴結中,Tregs可以關閉致病性T細胞的增殖和分化。 在發炎的組織中,Tregs可以改變效應T細胞的擴增和活化,細胞因子的產生,先天免疫細胞的活化,炎癥細胞的化學吸收以及表位擴散。
Tregs的免疫調節取決于通常提供抗原的APC參與。一旦被誘導,這些由可溶性介質和細胞表面受體介導的抑制活性正在以旁分泌的方式影響附近的所有細胞和組織。因此,可以使用工程化CAR和TCR將Tregs引導至靶組織中的任何細胞以實現局部免疫抑制。
其次,Tregs可以介導“傳染性耐受性”。Tregs不僅可以抑制炎癥,還可以創造有利于其他免疫抑制群體出現的組織微環境,這些免疫抑制群體包括具有額外特異性的Tregs,骨髓衍生的抑制細胞以及其他抑制性T細胞亞群(例如1型調節性Tr1細胞)。通過這種耐受性的傳染性傳播,治療性Treg的作用被擴增和生命延長,即使過繼轉移的Treg細胞不能無限期存活。
具有活體藥物的所有優點,可以運輸到目標組織,自動執行針對組織微環境的治療行動,根據治療需求擴大或縮小數量,并持續長期持續恢復,這是一個固有的挑戰。
Treg細胞療法是為了確保其譜系穩定性并防止抗原特異性Treg轉變為能夠造成組織損傷的效應T細胞。通過設計Treg細胞包括zi殺基因,分泌自分泌IL-2,缺失促炎細胞因子的受體和穩定FOXP3表達的調節機制,可以減輕這種風險。
同樣重要的是認識到單獨的Treg ACT可能不足以誘導耐受性,因為在許多情況下,預先存在的效應T細胞可能難以控制或可能數量上超過治療性Treg。如果要達到持久性的緩解作用,可能需要在施用抗原特異性Treg之前聯合使用減少效應物與炎癥的藥物,或者可能通過遺傳工程改造Tregs以減少炎癥,損害效應T細胞和促進耐受。
ACT的挑戰之一涉及與個性化治療相關的成本和技術難度
通過開發用于現成的通用T細胞,ACT在癌癥治療中正在應對這一挑戰。使用基因編輯方法,通過刪除多態性的人白細胞抗原來修飾異體T細胞,以保護細胞免受宿主免疫系統的破壞,并消除其內源性TCR以防止非特異性活性。
未來幾年對于確定Treg ACT的功效和實用性至關重要。然而如果癌細胞治療方法的爆發有任何跡象,我們相信Tregs將成為抗炎和致耐受性療法發展的下一個熱門風向標,也是未來投資者值得關注的領域。(生物谷)
參考出處:
science.sciencemag.org/content/362/6411/154.full
 您好, 歡迎來到化工儀器網
您好, 歡迎來到化工儀器網

 11
11


