巴氏吸管由醫用級聚乙烯(PE)制成,管體
2018年8月Cell期刊不得不看的亮點研究
2018年8月份結束了,8月份Cell期刊又有哪些亮點研究值得學習呢?小編對此進行了整理,與各位分享。
1.Cell:暫時忘記流式細胞儀吧,科學家們開發出智能圖像激活細胞分選技術
doi:10.1016/j.cell.2018.08.028
50多年來,基于流式細胞儀(flow cytometry)的細胞分選是依據細胞的表面標志物表達譜從物理上分離這些細胞,它已成為生物學實驗室中的一種廣泛使用的工具。但是,在一項新的研究中,來自一個研究團隊揭示出這個關鍵過程的進展,即“智能圖像激活細胞分選(Intelligent Image-Activated Cell Sorting, IACS)”。相關研究結果于2018年8月27日在線發表在Cell期刊上,論文標題為“Intelligent Image-Activated Cell Sorting”。
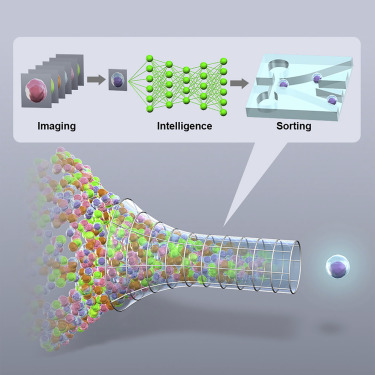
圖片來自Cell, doi:10.1016/j.cell.2018.08.028。
IACS是一種智能機器,它集成了光學、微流體、電學、計算和機械技術,不僅可以根據細胞的全局表型譜,還可以利用一種圖像驅動方法獲得細胞的空間和形態特性來對這些細胞進行分選。這些研究人員將推出一種開放式創新平臺,在這種平臺上,用戶可以在日本東京大學構建出的這種智能機器上提出想法和提交有趣的樣本進行測試。另外,一家初創公司CYBO公司(CYBO Inc.)將把這種IACS技術轉變為一種商業產品。
與所有流式細胞儀一樣,將含有懸浮細胞樣品的試管放置在注射口處,從而將它引導入這種IACS系統中。在運行過程中,讓細胞逐個地在顯微鏡透鏡下通過并進行成像;實時收集這些成像數據并用于制定分選決策,從而將符合標準的細胞與那些不符合標準的細胞在物理上分離開來。在完成分離后,收集一個含有經過分選的細胞樣品部分的試管和一個含有剩余的細胞樣品部分的試管,在在光學顯微鏡下檢查這兩個試管,并評價它們的產率和純度。與流式細胞儀不同的是,細胞依據它們的空間和形態學參數(比如細胞內的蛋白定位和細胞間相互作用)從大的異質群體中分離出來。
Goda說,“這種平臺即使采用深度學習算法,也能夠在32毫秒內完成圖像采集、圖像處理、決策制定和驅動,從而實現以每秒約100個細胞的速度進行實時的基于圖像的智能細胞搜索和分選。這種IACS技術具有廣泛的用途:能夠處理從微生物學到血液學等各種領域的各種類型和大小的細胞,并有望在生物科學、制藥和醫學科學領域利用這種機器取得新的發現。”
2.Cell:重磅!揭示大腦血清素系統至少由兩組血清素能神經元亞群組成
doi:10.1016/j.cell.2018.07.043
化學信使分子血清素(serotonin,也稱作5-羥色胺)與從情緒到運動調節的一切相關。但是迄今為止,人們還遠未明確血清素對哺乳動物大腦的影響。科學家們給出了不同的結果。一些人發現血清素能促進快樂。另一些發現它增加焦慮的同時抑制運動,而其他人持相反的觀點。
在一項新的研究中,來自美國斯坦福大學的Liqun Luo教授及其團隊著重關注腦干中的一個被稱作中縫背核(dorsal raphe)的區域,這個區域含有哺乳動物大腦中zui大密度的都通過釋放血清素傳遞信號的神經元(大約9000個)。相關研究結果于2018年8月23日在線發表Cell期刊上,論文標題為“Anatomically Defined and Functionally Distinct Dorsal Raphe Serotonin Sub-systems”。
這些中縫背核神經元的神經纖維或者說軸突與很多至關重要的執行著一系列功能(包括思考、記憶、情緒和身體功能的調節)的前腦區域形成一個龐大的連接網絡。通過注射感染這些區域中的血清素軸突(serotonin axon, 注:血清素能神經元的軸突)的病毒,這些研究人員能夠將這些連接追溯到它們在中縫背側中的原始神經元。
這允許他們構建出腦干中致密的血清素釋放神經元(serotonin-releasing neuron, 也稱作serotonin neuron,即血清素能神經元)到它們影響的多個前腦區域的神經投射的視覺圖譜。這種圖譜揭示出在中縫背核中至少存在著兩組不同的血清素能神經元,它們與大腦中的皮層和皮層下區域相連。
更重要的是,這些研究人員發現血清素能神經元本身比之前想象的更加復雜。投射到皮層區域的血清素能神經元并不僅僅利用血清素傳遞信息,還會釋放出一種叫做谷氨酸的化學信使,這讓它們成為大腦中釋放兩種不同化學物質的少數神經元之一。這就產生一個問題,即人們是否應當稱呼它們為血清素能神經元,畢竟神經元是根據它們釋放的神經遞質命名的。
總之,這些研究結果表明,大腦的血清素系統不是由同質的神經元群組成,而是由許多協同發揮作用的神經元亞群(或者說子系統)組成。Luo團隊鑒定出兩組神經元亞群,但可能存在著更多組的神經元亞群。
3.Cell:大腸桿菌竟促進宿主的鐵吸收能力
doi:10.1016/j.cell.2018.07.032
在一項新的研究中,美國科羅拉多大學波德分校的Bin Qi和Min Han證實作為一種導致食物中毒或從宿主身上偷走營養物的病原體而廣為人所知的大腸桿菌實際上通過產生一種幫助細胞攝取鐵的化合物在促進宿主健康中發揮著關鍵性作用。這項研究揭示出大腸桿菌讓它的宿主受益的機制,這可能導致人們開發出有效地治療影響著*10億多人的缺鐵性貧血(iron deficiency anemia)的方法。相關研究結果于2018年8月23日在線發表在Cell期刊上,論文標題為“Microbial Siderophore Enterobactin Promotes Mitochondrial Iron Uptake and Development of the Host via Interaction with ATP Synthase”。
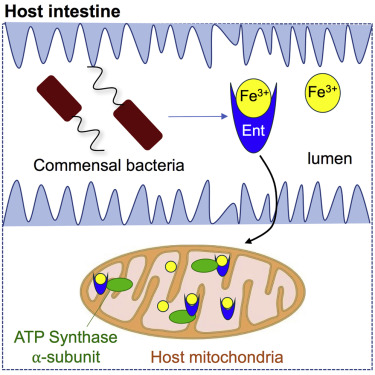
圖片來自Cell, doi:10.1016/j.cell.2018.07.032。
這項研究起始于利用秀麗隱桿線蟲(一種天然地富含大腸桿菌的線蟲)開展的一系列實驗。當給年輕的線蟲喂食經過基因改造后不能夠產生一種被稱作腸桿菌素(enterobactin)的化合物的大腸桿菌時,它們生長緩慢而且它們體內的鐵水平比較低。當將腸桿菌素重新導入這些線蟲時,它們恢復自然的生長速度,而且它們體內的鐵水平上升。
在線蟲和人細胞中的進一步實驗證實往飲食中添加腸桿菌素,即便在沒有加入鐵的情形下,也會顯著地增加細胞中的鐵水平。
科學家們長期以來一直認為大腸桿菌產生腸桿菌素旨在尋找鐵用于它自身的存活和增殖。但是他們猜測為了這個目的,它從它的宿主中偷取鐵,這經常被描述為“鐵戰爭(iron tug of war)”。但是這項新的研究挑戰了這一常規看法,提出腸桿菌素也結合到一種位于宿主線粒體內部的被稱作ATP合酶(ATP synthase)的蛋白上,從而將鐵吸入到宿主細胞中。
4.Cell:三維環境是細胞染色體分離的關鍵
doi:10.1016/j.cell.2018.07.042
科學家經常在塑料培養皿上平層地培養細胞。以這種方式培養的肝細胞在細胞分裂過程中分配它們的染色體方面是非常糟糕的。肝細胞不會在兩個子細胞之間平均地分配染色體。這種錯誤可能會破壞細胞的遺傳物質,這可能會讓在實驗室培養肝臟充滿挑戰。培養肝臟是再生醫學的目標。沒有人能夠做到這一點,這是因為在培養皿中培養的肝細胞變得如此混亂以至于它們不會正常地發揮作用。
在一項新的研究中,來自美國麻省理工學院和瑞士聯邦理工學院的研究人員比較了在培養皿中培養的肝細胞發生的分裂和小鼠體內的肝細胞發生的分裂。正如所料,染色體錯誤在實驗室培養皿中培養的小鼠肝細胞中堆積著。但是,當這些研究人員觀察小鼠肝臟內生長的細胞時,某些染色體分離缺陷并未發生。對肝細胞等一些細胞而言,環境就是一切。因此,從原生環境中分離出的細胞在體外無法正確地分離它們的染色體。相關研究結果于2018年8月23日在線發表在Cell期刊上,論文標題為“Chromosome Segregation Fidelity in Epithelia Requires Tissue Architecture”。論文通信作者為麻省理工學院的Angelika Amon和Kristin Knouse。
這也適用于其他的細胞類型。這些研究人員發現,來自小鼠乳腺和皮膚的細胞在染色體分離方面表現出類似的差異,這取決于它們的環境。這些結果提示著組織提供的外力有助于引導每個細胞內的染色體分離。
5.Cell:令人意外!細菌DNA遭受壓縮時仍保持它的基因表達
doi:10.1016/j.cell.2018.06.049
細菌引起許多嚴重疾病,如食物中毒和肺炎。科學家們面臨的挑戰是,引起疾病的細菌是非常有彈性的。比如,當諸如大腸桿菌之類的細菌經歷饑餓時,它們會大規模地重新組裝它們的DNA,從而使得它們能夠在應激條件下存活下來。 為了實現這一壯舉及提高存活機會,大腸桿菌菌株顯著增加一種被稱作Dps的蛋白的數量。這種蛋白將細菌DNA壓縮成致密的水晶狀復合物并保護其免受損傷。雖然之前的研究已表明Dps保護細菌免受饑餓和其他的應激因素,但是科學家們并不知道這種特殊的蛋白是如何發揮作用的。
在一項新的研究中,來自荷蘭卡夫利納米科學研究所、格羅寧根大學、代爾夫特理工大學、美國羅徹斯特大學和俄亥俄州立大學的研究人員描述了Dps有助細菌在應激條件下存活下來的一些*的特征。相關研究結果發表在2018年8月23日的Cell期刊上,論文標題為“Global DNA Compaction in Stationary-Phase Bacteria Does Not Affect Transcription”。論文通信作者為羅徹斯特大學生物學副教授Anne Meyer、夫利納米科學研究所的Elio Abbondanzieri和Nynke Dekker。
植物和動物等高等生物中的細胞不含有Dps。然而,它們也會做類似的事情。當它們不需要基因組的某些片段時,它們會包裹這些片段并進行壓縮。這種壓縮能夠有助讓DNA免受損傷,這是因為這會將DNA與細胞質的其他部分隔離開來。每當DNA在高等生物中遭受壓縮時,處于壓縮的基因組片段中的基因就更不可能表達。這些研究人員原本認為當細菌DNA被Dps壓縮時,他們會在細菌(一種低等生物)中觀察到同樣的效果。
但是,實際上,這些研究人員觀察到令人吃驚的結果:盡管Dps確實會壓縮細菌DNA,但是這種壓縮并不對基因表達產生任何影響。當遭受應激時,不論DNA是否被Dps壓縮,作為一種對基因進行轉錄的酶,RNA聚合酶(RNAP)能夠結合到DNA上,仍然能夠表達基因。大腸桿菌是他們觀察到的盡管DNA遭受強烈的壓縮但是基因表達沒有發生變化的shou個細菌。
這些研究人員觀察到盡管RNA聚合酶仍然能夠*接觸到遭受Dps壓縮的DNA,但是其他的能夠切割和破壞DNA的蛋白被*阻斷。因此,他們猜測Dps壓縮細菌DNA的目的可能是保護它免受破壞或突變,同時仍然允許細菌表達有助于其抵抗應激條件的基因。
6.Cell:重大進展!構建出哺乳動物單細胞染色質可接近性圖譜
doi:10.1016/j.cell.2018.06.052
科學家們對DNA纏繞和包裝到所謂的染色質中的方式感興趣,這是因為這會影響每個細胞中可用到的遺傳信息。DNA就像串在一根繩子上的念珠。在這些分子“念珠”移動的地方會有空間形成,這樣蛋白就能夠訪問和“讀取”遺傳信息。這種狀態或者說這種基因組特征就是染色質可接近性(chromatin accessibility, 也譯作染色質開放性)。
在一項新的研究中,來自美國華盛頓大學的研究人員利用他們之前開發出的一種被稱作sci-ATAC-seq的測定方法分析了來自13種成年雄性小鼠組織的近10萬個細胞。這些組織是骨髓、大腸、心臟、腎臟、肝臟、肺部、小腸、脾臟、睪丸、胸腺、全腦、小腦和大腦前額皮層。相關研究結果發表在2018年8月23日的Cell期刊上,論文標題為“A Single-Cell Atlas of In Vivo Mammalian Chromatin Accessibility”。論文通信作者為華盛頓大學的Cole Trapnell和Jay Shendure。

圖片來自Cell, doi:10.1016/j.cell.2018.06.052。
這些研究人員觀察到85種不同的染色質可接近性模式,并且能夠將大部分染色質可接近性模式分配給特定的細胞類型。他們還對40萬多個潛在的調節元件進行目錄編制。總體而言,他們能夠鑒定出具有類似的染色質可接近性模式的細胞群體,隨后對每個細胞群體進行研究以便篩選出不同的細胞類型。
7.Cell:挑戰常規!細胞周期的G1期和G2期是非常類似的
doi:10.1016/j.cell.2018.03.065
我們體內的細胞通過一個四階段過程進行增殖:在G1期間,細胞首先增加它們的質量并為DNA復制作好準備;在S期間,它們復制DNA;接下來,在G2期間,它們檢查重復DNA的保真度并組裝細胞分裂所需的材料;在有絲分裂期間,它們對復制的染色體進行排列并進行分裂。從一個階段過渡到下一個階段是受到嚴格調節的,需要組裝和分解各種蛋白復合物來執行許多不同的功能,包括提供細胞周期進展的分子檢查點。
長期以來,科學家們認為細胞周期的G1期和G2期處于不同的調節控制通路中,但是在一項新的研究中,來自新加坡科技研究局(A*STAR)分子與細胞生物學研究所的Pär Nordlund及其同事們推翻了這個觀點。他們發現在細胞周期的G1期和G2期中形成的蛋白復合物是非常類似的,這提示著當細胞沒有活躍地復制遺傳物質或進行自我分裂時,它本能地存在著一種默認的生化操作模式。相關研究結果近期發表在Cell期刊上,論文標題為“Modulation of Protein-Interaction States through the Cell Cycle”。
Nordlund和他的同事們分析了在細胞周期的4個階段過渡期間在人血細胞中發現的所有蛋白之間的相互作用狀態的動態變化。他們使用了Nordlund團隊之前開發出的一種技術,即細胞熱轉移測定(Cellular Thermal Shift Assay, CETSA),它能夠讓科學家們區分哪些蛋白獨立地存在著,哪些蛋白位于蛋白復合物中。
他們鑒定出750多種蛋白在細胞周期的某個時刻形成復合物或獨立存在著。然而,大多數這些發生變化的蛋白相互作用狀態在細胞周期的S期和有絲分裂期間發生,而不在細胞周期的G1期和G2期發生。
8.Cell:40年來,治愈急性白血病的方法近在咫尺
doi:10.1016/j.cell.2018.07.045
文章亮點:研究人員開發了一種同時靶向CKIα和CDK7/9的口服活性小分子抑制劑;晶體學分析為共靶向不同激酶的作用提供了結構基礎;這種抑制劑可以選擇性殺死AML前體細胞并治愈AML小鼠;治療的機理包括p53激活以及超級增強子(super-enhancers,SE)關閉。 清除CKIα會導致p53激活,而CKIα降解是來那度胺治療白血病前綜合征的機理。而近日來自耶路撒冷希伯來大學的研究人員開發了一種CKIα抑制劑,可以同時靶向轉錄激酶CDK7和CDK9,因此可以增強CKIα誘導的p53激活效果及其抗白血病效果。
癌基因驅使的SEs對于抑制CDK7/9高度敏感。研究人員找到了原發性小鼠急性髓性白血病(AML)細胞中的多種新獲得的SEs,研究人員發現這些抑制劑可以清除許多SEs,并傾向于抑制SE驅使的癌基因的轉錄延伸研究人員發現同時抑制CKIα和CDK7/9可以穩定p53,抑制白血病癌細胞的生存、維持增殖的癌基因驅使的SE,并誘發凋亡。
抑制劑可以選擇性清除白血病前體細胞,這也就解釋了這些抑制劑在保持造血功能的同時治愈白血病的潛能。
9.Cell:重大發現!跳躍基因劫持卵子發生大規模傳播自身拷貝
doi:10.1016/j.cell.2018.06.040
我們的DNA序列中的將近一半是由跳躍基因(也被稱為轉座子)組成的。它們在發育中的卵細胞的基因組內跳躍,而且在進化中起著重要的作用。但是,它們的移動也會導致新的突變,從而引發血友病和癌癥等疾病產生。值得注意的是,人們對它們在發育中的生殖細胞內移動的時間和地點知之甚少。畢竟,這是確保跳躍基因在后代中傳播的關鍵過程,但也可能導致宿主患上遺傳疾病。
為了解決這個問題,在一項新的研究中,來自美國卡內基科學研究所的研究人員開發了一種新技術來追蹤跳躍基因移動。他們發現,在一個特定的卵子發育期間,一組被稱作逆轉錄轉座子(retrotransposon)的跳躍基因劫持了被稱作哺育細胞(nurse cell)的特殊細胞,其中哺育細胞滋養著發育中的卵子。這些跳躍基因利用哺育細胞產生侵入性物質(它們自身的拷貝,也被稱為病毒樣顆粒),這些侵入性物質會遷移到附近的卵子中,隨后被整合到這個卵子的DNA中。相關研究結果于2018年7月26日在線發表在Cell期刊上,論文標題為“Hijacking Oogenesis Enables Massive Propagation of LINE and Retroviral Transposons”。
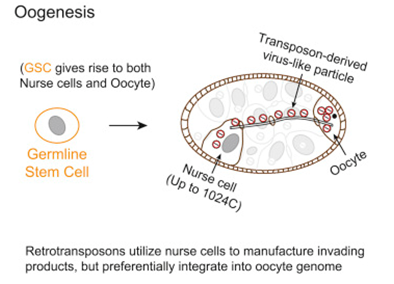
圖片來自Cell, doi:10.1016/j.cell.2018.06.040。
在這項新的研究中,這些研究人員以黑腹果蠅(Drosophila melanogaster)為研究對象,開發出追蹤跳躍基因移動的方法。為了便于開展研究,他們破壞了piRNA抑制以增加這些跳躍基因的活性,然后在卵子發育過程中監測它們的移動。這導致他們發現了允許跳躍基因移動的策略。
論文通信作者、卡內基科學研究所研究員Zhao Zhang說,“我們非常吃驚地發現這些跳躍基因幾乎不會在產生發育中的卵細胞的干細胞內移動,這可能是因為這些干細胞僅有兩個基因組拷貝供這些跳躍基因使用。相反,這些跳躍基因使用起支持作用的哺育細胞,每個哺育細胞提供多達數千個基因組拷貝,這樣它們就可作為大規模制造病毒樣顆粒的工廠。不過,它們并沒有整合到產生它們的哺育細胞中。相反,它們等待時機,直到它們被運送到與哺育細胞連接在一起的卵細胞中,在那里,跳躍基因的上百個新的自身拷貝被整合到卵子DNA中。我們的研究展示了寄生性遺傳元件如何根據時間調整它們的活性和區分不同的細胞類型以便強勁地傳播它們的自身拷貝、促進進化變化和導致疾病。”
10.Cell:科學家有望成功繪制出人類大腦神經系統詳細圖譜 或能闡明多種神經性疾病的發生根源
doi:10.1016/j.cell.2018.06.021
近日,一項刊登在雜志Cell上研究報告中,來自瑞典卡羅琳學院的研究人員通過研究繪制出了小鼠神經系統中多種細胞類型的系統且全面詳細的圖譜,該圖譜或能為研究人員提供揭示機體神經性疾病起源的線索,此外,研究人員還能利用相同的方法來繪制出關于人類大腦的詳細圖譜。
這些研究人員利用小鼠作為模型系統,對哺乳動物機體神經系統的架構和組成進行了大規模的研究,研究者終共鑒別出了265種不同類型的細胞,同時還發現,神經元細胞的多樣性甚至超過了200種。讓研究人員非常不可思議的是大腦不同部位存在著多種特殊的不同類型的星狀細胞,這或許就表明,這些星狀細胞在大腦不同部位扮演著特殊的功能,而且其在大腦中所扮演的角色要比研究人員理解的更重要。
對大腦中不同類型細胞的研究或能幫助研究人員理解不用疾病的起源,大約三分之一的神經系統疾病是在胚胎發育過程中產生的,在過去15年里,研究人員進行大量遺傳學研究鑒別出了誘發多種疾病的特殊致病基因,比如精神分裂癥、多發性硬化癥、自閉癥、阿爾茲海默病和帕金森疾病等,然而根據相關基因表達的時間和地點,這些疾病常常都起源于一種特殊類型的細胞、一段特殊的區域或一個特定的時間點。
在這種新型神經系統圖譜的幫助下,研究人員就能夠在特殊類型的細胞中鎖定致病基因,對于有效闡明疾病發生機制提供了新的線索,同時也能幫助研究人員開發出新型療法來治療相關的神經性疾病。對小鼠機體神經系統圖譜的繪制是一項重大的研究進步,后期研究人員還將繼續深入研究,利用相同的方法來繪制出人類大腦的詳細圖譜。(生物谷)
 您好, 歡迎來到化工儀器網
您好, 歡迎來到化工儀器網

 11
11


