巴氏吸管由醫用級聚乙烯(PE)制成,管體
結構生物學領域研究進展
本期為大家帶來的是結構生物學領域的研究進展,希望讀者朋友們能夠喜歡。
1.Nature & Science:冷凍電鏡技術揭示Hedgehog信號復合體的結構
DOI: 10.1126/science.aas8843
DOI: 10.1038/s41586-018-0308-7

Hedgehog信號通路對于胚胎細胞的發育具有重要的作用,該信號的缺失會導致先天性缺陷的發生。然而,對于多數癌癥。例如基底細胞癌、腦癌、乳腺癌以及前列腺癌來說,該信號的強度卻失去了控制。
冷凍電鏡技術的發展幫助我們揭示了Hedgehog信號的分子機制。通過對蛋白結構的進一步認知,能夠幫助我們開發靶向該信號的藥物分子。
在近發表在《Science》雜志上的一篇研究中,來自西南醫學中心以及洛克菲勒大學的研究者們解析出了原子水平的蛋白結構。研究結果顯示,兩個PTCH-1分子能夠同時結合一個Hedgehog(HH)分子,但結合位點處于不同的部位。這一結合方式對于該信號的傳遞是十分必要的。
冷凍電鏡的好處在于能夠將樣品溫度降至足夠低,從而不會有冰晶的產生。這一技術對于觀察分子結構具有很大的幫助。
在上個月發表在《Nature》雜志上的文章中,作者等人利用冷凍電鏡技術解析了PTCH1與HH一對一的結合結構。生化檢測結果表明這種結合方式并不能充分地釋放其活性。
“在近的這篇文章中,我們發現PTCH1與HH二對一的結合方式。即一個HH分子通過其表面兩個不同的表位分別于兩個PTCH1進行結合。細胞生物學檢測結果驗證了這種結合方式對于信號的產生以及傳遞的重要性。與之前的文章結合,我們希望這些結構有助于研究者們對該領域的認知的進一步深入”,作者們說道。
2. Science:重大突破!顏寧課題組從結構上揭示人Ptch1蛋白識別Shh機制
doi:10.1126/science.aas8935.
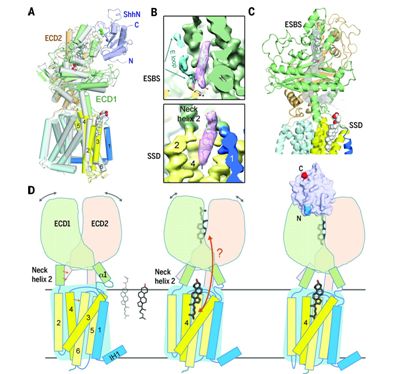
Hedgehog(Hh)通路對胚胎發生和組織再生是至關重要的。Hh信號是通過分泌的和脂質修飾的蛋白Hh結合到膜受體Patched(Ptch)上而被激活的。在缺乏Hh的情況下,Ptch通過一種未知的間接機制抑制下游的G蛋白偶聯受體Smoothened(Smo)。
Hh與Ptch的結合減輕了對Smo的抑制并且開啟讓Hh通路遭受轉錄激活的信號轉導事件。Hh信號異常與出生缺陷或腫瘤發生有關。盡管進行了嚴密的研究,Hh、Ptch和Smo之間相互作用的分子基礎仍是不清楚的,而且Ptch和Hh之間識別的結構基礎還有待闡明。
經預測長1447個氨基酸殘基的人Ptch1蛋白含有12個跨膜區段(TM),并且與細菌RND家族轉運蛋白(resistance-nodulation-division family transporter, RND家族轉運蛋白)存在著結構類似性。Ptch1的跨膜區段2(TM2)至TM6構成固醇敏感多肽區(sterol-sensing domain, SSD)。人們已在幾種參與固醇轉運和代謝的蛋白中發現了SSD。這些含有SSD的蛋白的潛在固醇結合或轉運活性的分子機制仍然是不清楚的。
在一項新的研究中,為了獲得適合于結構研究的樣品,來自中國清華大學的研究人員基于序列保守性和功能表征獲得幾種人Ptch1的構建體。終,在人胚胎腎293F細胞中瞬時表達的含有氨基酸殘基1~1305的人Ptch1截短版本在親和層析純化和尺寸排阻層析純化后表現出足夠的表達水平和良好的溶液行為。他們還觀察了Ptch1的寡聚體狀態和單體狀態。Ptch1的單體形式可適用于單粒子低溫電子顯微鏡分析,這是因為它在低溫條件下具有優異的性能。相關研究結果發表在2018年8月10日的Science期刊上,論文標題為“Structural basis for the recognition of Sonic Hedgehog by human Patched1”。論文通信作者為清華大學醫學院教授顏寧(Nieng Yan)博士。
在三種哺乳動物Hh同源物Sonic(Shh)、Desert(Dhh)和Indian(Ihh)中,Shh一直是功能和機制研究的原型。在大腸桿菌中表達和純化的人Shh的N-端結構域(ShhN, 氨基酸殘基24~197)能夠在膽固醇琥珀酸單酯(cholesteryl hemisuccinate, CHS)的存在下與去污劑溶解的Ptch1蛋白形成一種穩定的復合物。
顏寧課題組分別在3.9埃分辨率下和在3.6埃分辨率下解析出人Ptch1單獨時以及它與ShhN結合在一起時的低溫電鏡結構。他們識別出兩個相互作用的胞外結構域ECD1和ECD2,以及12個跨膜區段(TM1~12)。一旦ShhN結合,ECD1和ECD2向彼此移動,而且它們一起構成ShhN的停靠位點。顏寧課題組對ShhN與Ptch1之間的詳細識別進行了分析和生化驗證。
在具有或不具有ShhN的Ptch1中觀察到兩個與CHS相一致的類固醇密度(steroid-shaped density):一個在由這兩個胞外結構域包圍的口袋中,另一個在SSD的膜面向的腔中。基于結構的生化分析揭示出ShhN和Ptch1之間的類固醇依賴性相互作用。相比于野生型Ptch1,類固醇結合缺陷型Ptch1突變體的結構表現出顯著的構象重排。
總之,人Ptch1單獨時及其與ShhN結合在一起時的結構揭示出Ptch1和ShhN之間識別的分子基礎。在Ptch1中鑒定出兩個類固醇結合位點為在未來研究Hh信號建立了重要的框架,并對含有SSD蛋白的固醇感知提供了關鍵見解。
3. Cell:重磅!破解人cGAS的三維結構,揭示它為何識別長片段DNA同時忽略短片段DNA
doi:10.1016/j.cell.2018.06.026

人體是為生存而建造的。人體中的每一個細胞都受到一組免疫蛋白的嚴密保護,而且這些免疫蛋白裝備了幾乎*的雷達來檢測外來的或受損的DNA。
人細胞中的一個為關鍵的哨兵是一種被稱作cGAS的“響應者”蛋白,它檢測外來的和發生癌變的DNA的存在,并啟動一種信號級聯反應,從而觸發身體防御。
2012年蛋白cGAS的發現引發了科學探究的風暴,迄今為止,科學家們已針對它發表了500多份研究出版物,但是人cGAS蛋白的結構和關鍵特征仍然困擾著科學家。
如今,在一項新的研究中,來自美國哈佛醫學院和達納-法伯癌癥研究所的研究人員鑒定出人cGAS蛋白與其他哺乳動物中的GAS蛋白之間的結構差異和功能差異,并揭示出它在人體中發揮*功能的結構基礎。這項研究概述了人cGAS蛋白的結構特征,這些結構特征解釋了人cGAS為何和如何識別某些類型的DNA同時忽略其他類型的DNA。相關研究結果發表在2018年7月12日的Cell期刊上,論文標題為“Structure of the Human cGAS–DNA Complex Reveals Enhanced Control of Immune Surveillance”。
論文通信作者、哈佛醫學院/達納-法伯癌癥研究所微生物學與免疫生物學助理教授Philip Kranzusch說,“人cGAS的結構和作用機制一直是免疫學和癌癥生物學領域中的一個關鍵的缺失部分。我們的研究結果詳細闡述了人cGAS的分子組成和功能,從而彌補了我們的知識中的這個重要的缺口。”
重要的是,這些研究結果能夠為設計適合人cGAS蛋白的*結構特征的小分子藥物提供了信息---這一進展有望改進當前作為抗癌療法正在開發中的cGAS調節藥物。
Kranzusch說,“當前正在開發中的幾種有前途的實驗性免疫療法是針對小鼠cGAS的結構而被開發出的,它與人cGAS存在著關鍵的結構差異。我們的發現應該有助于優化這些實驗性療法并促進人們設計出新的療法。這將為結構導向地設計調節這個基礎蛋白活性的藥物鋪平道路。”
Kranzusch團隊的研究結果解釋了人cGAS蛋白的一個*特征---相比于其他動物中的cGAS蛋白,它能夠高度選擇性地檢測某些類型的DNA而且它更不容易被激活。
具體而言,這項研究表明人cGAS攜帶的突變使得它對長片段DNA非常敏感,但是也讓它對短片段DNA“不敏感”。
論文共同作者、哈佛醫學院微生物學與免疫生物學系博士后研究員Aaron Whiteley說,“人cGAS是一種高度選擇性的蛋白,它已進化出更強的DNA特異性。我們的實驗揭示出這種能力的基礎。”
在所有哺乳動物中,cGAS都是通過檢測處于錯誤位置的DNA來發揮作用的。在正常條件下,DNA被緊密地包裝在細胞核中并受到保護。DNA沒有理由會在細胞周圍自由移動。當DNA片段確實終逃離細胞核并進入細胞質中時,這通常表明存在著一些不祥之兆,比如來自細胞內的損傷或來自侵入細胞內的病毒或細菌的外來DNA。
cGAS蛋白通過識別這種處于錯誤位置的DNA而發揮作用。在正常情形下,它在細胞中處于休眠狀態。但是一旦cGAS檢測到DNA存在于細胞核外面,它就突然起作用。它產生另一種化學物質---一種被稱作cGAMP的第二種信使,從而引發一種分子鏈反應,結果就是提醒細胞中的DNA異常存在。在這種信號級聯反應結束時,細胞要么得到修復,要么因損壞到無法修復的地步,它就會自我破壞。
但是細胞的健康和完整性取決于cGAS能夠將無害的DNA和外來DNA或在細胞遭受損傷和應激期間釋放出的自身DNA區分開來。
論文共同作者、哈佛醫學院/達納-法伯癌癥研究所博士后研究員Wen Zhou說,“這是一種很好的平衡行為,可確保免疫系統保持平衡。過度活躍的cGAS能夠引發自身免疫反應或自我攻擊,而未能檢測到外來DNA的cGAS能夠導致腫瘤生長和癌癥進展。”
這項新的研究揭示出這種蛋白結構的進化變化,從而允許人cGAS忽略它遇到的一些DNA,同時對它遇到的其他DNA作出反應。
就這項新的研究而言,這些研究人員的研究對象是霍亂弧菌(Vibrio cholerae)。這種細菌會導致霍亂,也是人類古老的禍害之一。
利用一種與cGAS具有相似性的霍亂弧菌酶,這些研究人員能夠在這種細菌中重建人和小鼠cGAS蛋白的功能。
通過與來自哈佛醫學院細菌學家John Mekalanos實驗室的同事們合作,這些研究人員設計出一種嵌合或雜合形式的cGAS,它包括來自人類和小鼠cGAS的遺傳物質。隨后,他們將這種雜合cGAS識別DNA的能力與完整的人cGAS和小鼠cGAS的識別能力進行比較。
在一系列實驗中,這些研究人員觀察了這些不同類型cGAS之間的激活模式,并逐步縮小導致這三者之間存在不同DNA激活模式的關鍵差異。
這些實驗表明在人類和小鼠cGAS中存在差異的116個氨基酸中,僅兩個氨基酸導致人cGAS的功能變化。確實,人cGAS能夠高精度地識別長片段DNA,但它會忽略了短片段DNA。相反,小鼠cGAS不能區分長片段DNA和短片段DNA。
Whiteley說,“這兩個微小的氨基酸發揮著如此重大的作用。它們讓人cGAS具有高度選擇性,僅對長片段DNA作出反應,同時忽略短片段DNA,這就使得人cGAS更能耐受DNA在細胞質中的存在。”
通過在進化時間尺度上繪制遺傳分歧,這些研究人員確定人類和小鼠cGAS基因在1000萬到1500萬年前的某個時間分開。
負責檢測長片段DNA和耐受短片段DNA的這兩個氨基酸僅在人類和非人靈長類動物(比如大猩猩,黑猩猩和倭黑猩猩)中發現到。
這些研究人員猜測忽略短片段DNA但識別長片段DNA的能力必定會帶來一些進化上的好處。
Kranzusch說,“這可能是一種阻止過度活躍的免疫系統和慢性炎癥的方法。或者這可能是通過不識別短片段DNA來降低患上某些人類疾病的風險。”
在后一組實驗中,這些研究人員解析出人cGAS的活性形式與DNA結合在一起時的原子結構。
為了做到這一點,他們使用了一種被稱作X射線晶體衍射的可視化技術。這種技術能夠基于X射線衍射圖案揭示出蛋白晶體的分子結構。
分析人cGAS“在發揮作用時”的結構揭示出讓它能夠選擇性地結合長片段DNA同時忽略短片段DNA的分子變異。
Kranzusch說,“理解是什么讓人cGAS的結構和功能與其他物種cGAS存在的差異正是這個缺失的部分。如今,我們解析出它的結構,我們真地能夠開始設計適用于人體而不適用于小鼠的藥物。”
4.多篇Nature論文解析出結合到DNA上的起點復制復合物的高清晰結構
doi:10.1038/nature14685.
doi:10.1038/nsmb.3374.
doi:10.1038/s41586-018-0293-x.
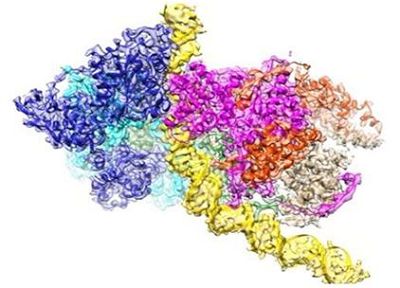
細胞通過基因組復制產生自身的拷貝而進行增殖。按理說,DNA復制是所有生命形式中基本和保守的機制。破解這一過程是如何地實現的秘密是理解生命秘密的關鍵。當沃森和克里克在半個多世紀前基于DNA雙螺旋結構提出DNA的復制方式時,許多人認為將兩條DNA鏈分開進行復制的分子機器(即DNA復制機器,或者說DNA復制復合物)的結構即將出現。然而,鑒于這種分子機器具有比較大的尺寸、三重特性(它由三個引擎組成)和靈活性,它遠要比之前想象的復雜得多。利用常規方法無法獲得這種DNA復制機器在原子分辨率下的結構信息。近年來,隨著高分辨率的低溫電鏡(cryo-EM)技術的來臨,人們才能獲得它在原子分辨率下的結構信息。
中國北京大學的高寧(Ning Gao)團隊和中國香港科技大學的Bik-Kwoon Tye團隊合作發表的一系列論文為以的分辨率破解DNA復制機器的功能打開了大門。篇論文于2015年發表在Nature期刊上,它解析出這種被稱作微小染色體維持蛋白復合物(minichromosome maintenance complex, MCM蛋白復合物)的DNA復制機器的核心引擎的結構。第二篇論文報道了Cdt1-Mcm2-7復合物(作為MCM雙六聚體復合物的前體)的開環結構。如今,第三篇論文發表在Nature期刊上,它詳細地說明了起始識別復合物(Origin Recognition Complex, ORC)的原子結構,其中ORC復合物選擇全基因組中的復制起始位點以便啟動DNA復制。
在單個細胞(受精卵)經過大約1016次細胞分裂后,每個人就產生了。每次細胞分裂都需要基因組的復制,這樣每個子細胞都以DNA的形式獲得*相同的遺傳信息。
導致細胞分裂失調的異常DNA復制是許多癌癥和發育障礙的原因。基因組復制在維持活的有機體方面同樣起著重要的作用,這是因為所有細胞都具有“有效期限”,并且大多數細胞都由保留分裂能力的干細胞進行補充。
衰老也是這種復制機器發生故障(無論是發生在受損DNA的修復合成中,還是發生在全基因組復制的保真度中)的一般現象。在第三篇論文中,中國北京大學的高寧教授和中國香港科技大學的Bik-Kwoon Tye教授和Yuanliang Zhai博士利用低溫電鏡技術在原子分辨率下解析出啟動DNA復制的ORC復合物的結構。這種結構解釋了ORC復合物如何能夠掃描大量的堿基(DNA由A、T、G和C四種堿基組成),從中選擇出正確的位點開始進行DNA復制。據信,不加區分地選擇太多的位點可能導致基因組的快速復制并因此導致快速的細胞分裂,這是癌細胞的特征。相比之下,低效地選擇位點會導致細胞分裂緩慢,特別是在人類發育的關鍵時刻,這可能導致發育障礙。
一個典型的病例是Meier-Gorlin綜合征(MGS),這是一種罕見的遺傳性侏儒癥,其特征是產前發育遲緩和產后比例矮小的身材。有趣的是,與Meier-Gorlin綜合征相關的突變位于5個基因(ORC1、ORC4、ORC6、CDT1和CDC6)中,所有的這些基因都是這種DNA復制起始機器(即ORC復合物)的組分。ORC1和ORC4發生突變的患者似乎具有嚴重的身材矮小。在第三篇論文中,高寧教授和Bik-Kwoon Tye教授等證實在形成這種DNA復制起始機器的六個亞基中,ORC1和ORC4在復制起始位點的選擇機制中起著決定性作用。
從根本上說,ORC復合物的重要功能是招募MCM雙六聚體復合物到DNA復制起點上,其中MCM雙六聚體復合物是將雙鏈DNA分離開的DNA解旋酶的催化核心。在第三篇論文中報道的ORC復合物結合到DNA上時的原子結構揭示出ORC復合物導致的DNA彎曲為DNA插入到MCM解旋酶的開環結構中提供一個停泊表面。再者,它揭示出DNA復制起點是基于它的*結構而不是基于它的特定堿基序列而被選擇出來的。這些新發現有助于解釋ORC復合物如何在基因組中的*位點上選擇復制起點,而且這些位點僅由它們的堿基序列是無法預測到的。
DNA復制是所有有機體的一個決定性特征,而且執行這一功能的DNA復制機器從真菌到植物到人類都是保守的。理解這種DNA復制機器(或任何生物分子機器)的原子結構是至關重要的,這是因為所有的應用技術和工程技術都建立在基礎科學/知識的基礎之上。比如, DNA復制機器在3埃分辨率下的三維結構圖可能有助我們鑒定出更好的癌癥治療靶標,這樣就可定制產生適合這種靶標的合成化學物。更重要的是,這些結構有助于我們充分理解分子機器的作用機制,從而有助我們理解因這些分子機器未發揮jia功能而導致的疾病的根源。為實現這一目標,中國香港科技大學將建立先進的低溫電子顯微設備,用于研究生物分子機器的高分辨率結構。
5. Nature:重大進展!解析出人突觸GABAA受體的三維結構,有望開發出治療癲癇等神經疾病的新型藥物
doi:10.1038/s41586-018-0255-3
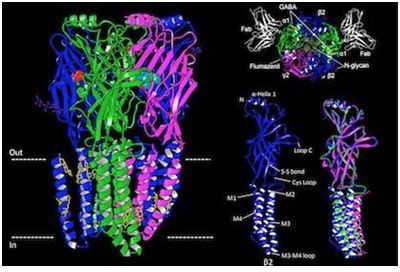
許多藥物---不論是合法的還是非法的---都作用于大腦中為豐富和為重要的神經遞質受體之一:A型GABA受體(type A GABA receptor, GABAA受體)。特別的是苯二氮平類藥物(benzodiazepine),它們用于外科手術期間的麻醉,并用于治療癲癇、焦慮和失眠。解析出這種受體的三維結構有朝一日可能導致人們開發出更好地治療這些疾病的方法。
GABAA受體與γ-氨基丁酸(GABA)結合,其中GABA是成年大腦中主要的抑制性或鎮靜性神經遞質。為了正常地發揮作用,大腦需要平衡刺激性信號和鎮靜性信號。GABAA受體功能障礙在以大腦中過度興奮為特征的疾病(如癲癇)中發現到。除了鎮靜劑苯二氮平類藥物之外,GABAA受體是巴比妥類藥物、麻醉藥和酒精的常見靶標。所有的這些藥物都通過增加GABAA受體的活性而作用于大腦,從而進一步抑制大腦活動。
*,GABAA受體的三維結構很難利用X射線衍射晶體分析法解析出。長期以來,這種方法被認為是結構生物學的黃金標準。它需要蛋白結晶,這樣就能夠根據X射線衍射圖譜來確定蛋白結構。
在一項新的研究中,來自美國德克薩斯大學西南醫學中心的研究人員尋求低溫電鏡技術(cryo-EM)的幫助。他們利用cryo-EM技術成功地解析出GABAA受體結合到GABA和藥物氟馬西尼(flumazenil)上的三維結構。相關研究結果于2018年6月27日在線發表在Nature期刊上,論文標題為“Structure of a human synaptic GABAA receptor”。論文通信作者為德克薩斯大學西南醫學中心神經科學與生物物理學助理教授Ryan Hibbs博士。論文作者為Hibbs實驗室博士后研究員Shaotong Zhu博士。
這些研究人員在燒瓶中利用細胞表達人突觸GABAA受體并加以純化,并將電生理學實驗和利用cryo-EM技術獲得的結構信息結合在一起來測試di西泮(一種苯二氮卓類藥物)和氟馬西尼對這種GABAA受體的影響,其中氟馬西尼用于逆轉麻醉和治療苯二氮平類藥物過量 Hibbs博士說,“我們能夠確定GABA如何選擇性地與這種受體結合,并解釋諸如苯二氮卓類藥物和氟馬西尼---它競爭性地作用于相同的位點上來逆轉苯二氮卓類藥物的效果---之類的藥物為何特異性地作用于這種受體上。這對于理解藥物結合機制和設計治療多種神經疾病的新藥產生深遠的影響。”
6. Nature:重大突破!從結構上揭示間日瘧原蟲入侵人紅細胞機制
doi:10.1038/s41586-018-0249-1
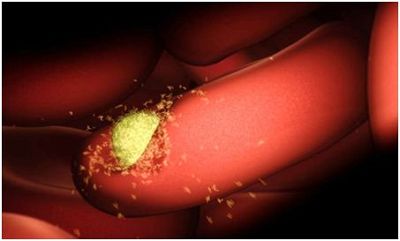
瘧原蟲入侵人體的年輕紅細胞,隨后開始在整個身體中擴散。在一項新的研究中,來自澳大利亞和美國的研究人員利用低溫電鏡技術(cryo-EM)在原子水平上揭示出間日瘧原蟲(Plasmodium vivax)如何入侵人體紅細胞的三維藍圖。他們繪制出這種瘧原蟲與它們入侵的年輕紅細胞之間的接觸,從而破解了它們用來附著到人紅細胞上的分子機器---間日瘧原蟲蛋白PvRBP2b與人轉鐵蛋白受體1(TfR1)和轉鐵蛋白結合在一起而形成的一種三元入侵復合物---的三維結構。這為開發新型瘧疾疫苗邁出了重要的一步。相關研究結果于2018年6月27日在線發表在Nature期刊上,論文標題為“Cryo-EM structure of an essential Plasmodium vivax invasion complex”。論文通信作者為美國霍華德休斯醫學研究所研究員Zhiheng Yu博士和澳大利亞沃爾特-伊麗莎-霍爾醫學研究所的Wai-Hong Tham博士。論文作者為沃爾特-伊麗莎-霍爾醫學研究所的Jakub Gruszczyk博士和霍華德休斯醫學研究所的Rick Huang博士。
今年初,在一項發表在Science期刊上的研究中,這些研究人員已發現間日瘧原蟲通過劫持人轉鐵蛋白受體入侵人體紅細胞(Science, doi:10.1126/science.aan1078,詳情參見生物谷新聞報道:重磅!開發瘧疾疫苗有戲!揭示間日瘧原蟲通過劫持人轉鐵蛋白受體入侵紅細胞)。如今,在革命性的cryo-EM技術的幫助下,他們能夠在原子水平下可視化觀察PvRBP2b與TfR1和轉鐵蛋白之間的相互作用。這就為開發潛在的抗瘧疾藥物和疫苗奠定基礎。
間日瘧原蟲是世界上分布為廣泛的瘧原蟲,也是非洲以外絕大多數國家中的瘧疾病例的主要原因。鑒于它隱藏在人體肝臟中而不被免疫系統檢測到,它也是導致復發性瘧疾感染的*瘧原蟲。
在這種三維結構的指導下,這些研究人員能夠解析出這種瘧原蟲-宿主相互作用的確切細節,并鑒定出它的為脆弱的位點。
Tham說,“這基本上是一項設計挑戰。間日瘧原蟲是非常多樣化的,這對疫苗開發具有挑戰性。我們如今鑒定出這種分子機器,它將是開發出有效地抵抗一系列間日瘧原蟲的抗瘧劑疫苗的hao靶標。”
她說,“憑借這種的細節,我們如今能夠開始設計專門靶向和破壞這種瘧原蟲的三元入侵復合物的新型療法,以便阻止它們劫持人紅細胞并通過血液在體內擴散,從而終阻止它們傳播給其他人。”
7. Science:從結構上揭示tau蛋白與微管之間的相互作用,有助深入認識神經疾病
doi:10.1126/science.aat1780
微管在維持細胞形狀、啟動某些形式的運動、促進胞內轉運和在有絲分裂期間分離染色體方面發揮著重要的作用。每個微管是由十三條平行的微管蛋白原絲組成的空心圓柱體。
tau蛋白有助于讓微管保持穩定和成束地組裝它們。突變或翻譯后修飾,比如降低tau蛋白對微管的親和力的高度磷酸化,被認為導致tau蛋白纏結物形成。
在一項新的研究中,來自美國勞倫斯伯克利國家實驗室和加州大學伯克利分校的研究人員利用低溫電鏡技術對結合到微管上的天然的全長的成熟的tau蛋白進行成像,成像整體分辨率為4.1埃。他們證實tau蛋白沿著微管蛋白原絲(tubulin protofilament)縱向結合著,這一發現與之前的低分辨率低溫電鏡研究相一致。相關研究結果于2018年5月10日在線發表在Science期刊上,論文標題為“Near-atomic model of microtubule-tau interactions”。論文通信作者為勞倫斯伯克利國家實驗室分子生物物理學與綜合生物成像部門資深科學家Eva Nogales。
tau蛋白是一種內在無序的蛋白,包括一個突出結構(projection domain)域,一個含有4個不完整重復序列的微管結合區和一個羧基端結構域。作為一種二聚體,微管蛋白是由α-微管蛋白和β-微管蛋白緊密連接在一起形成的。微管蛋白二聚體通過首尾相連形成組成微管的微管蛋白原絲。
鑒于大量的文獻都未報道tau蛋白的結構,人們并不確定它實際上是否會與微管蛋白發生有序的相互作用。
為了測試關于tau蛋白的哪些氨基酸殘基參與與微管蛋白結合的假設,這些研究人員構建出含有由4個相同的重復序列組成的微管結合區的合成tau構建物(synthetic tau construct),并對這些與微管結合在一起的tau構建物進行成像觀察(整體分辨率為3.2~3.9埃)。Nogales實驗室博士后研究員Simon Poepsel之前作為研究生時就已研究了tau的淀粉樣蛋白形式,并且在純化和制備用于低溫電鏡觀察的樣品中發揮著重要的作用。
Nogales實驗室博士后研究員Elizabeth Kellogg說,“當我們終觀察到tau蛋白中的重復序列長度并且發現它具有確定的結構和結合位點時,我們意識到tau蛋白實際上與微管蛋白表面形成特定的相互作用。當我們能夠讓這一發現與這種重復序列的長度和我們已有的這種序列信息保持一致時,我們的關鍵就在于要弄清楚如何充分地對這種結構重建進行改進以便實現原子建模。”
這些研究人員尋求了Rosetta的幫助。Rosetta是一套全面的計算建模工具,用于根據氨基酸序列信息(如構象和低能量狀態)預測大分子的三維原子結構。
Nogales解釋道,這些高分辨率的低溫電鏡圖片讓他的團隊能夠對這種分子復合物的整體形狀進行限制,從而提高了這種結構模型的保真度。
針對兩種不同的合成tau構建物的Rosetta結構預測都指向一個相同的解決方案:橫跨3個微管蛋白單體的27個氨基酸殘基的骨架區段。Nogales說,“來自兩張獨立的結構圖的相同序列寄存器和原子細節強調了我們的這個解決方案的穩健性,并為我們的原子模型的準確性提供了高度的信心。”
Kellogg說,“我們的結構顯示了tau蛋白與微管表面的主要接觸位點是如何處于微管蛋白亞基之間的界面上,起著促進微管蛋白亞基之間結合的‘訂書釘’的作用,并解釋tau蛋白如何促進微管穩定性。這種該結構還解釋了tau蛋白磷酸化如何導致它從微管上脫離下來。”
人們已觀察到位點262處的絲氨酸磷酸化(在tau蛋白的重復序列中普遍保守)會減弱微管結合并且是阿爾茨海默病的一種標志物。這種結構模型表明在這個關鍵的錨定點發生磷酸化會破壞tau蛋白和微管之間的相互作用,從而導致“這些訂書釘脫落”。這些研究人員還鑒定了在tau蛋白-微管結合中起著至關重要作用的其他氨基酸殘基。(生物谷)
 您好, 歡迎來到化工儀器網
您好, 歡迎來到化工儀器網

 11
11


