巴氏吸管由醫用級聚乙烯(PE)制成,管體
CRISPR技術再升級——單堿基的編輯
| 導讀 | 美國哈佛大學David R. Liu課題組創新性的開發了基于CRISPR/Cas9的單堿基編輯器(base editor, BE),有效地解決了修復致病基因點突變難題。 |
CRISPR/Cas9基因組編輯系統來源于簡單的細菌免疫系統組分,經過改造后可在真核細胞中實現高度靈活且特異的基因組編輯。該系統是單RNA(single-guide RNA, sgRNA) 介導的核酸酶系統,通過靶點特異的CRISPR RNA (crRNA)序列與靶序列進行堿基配對從而引導Cas9蛋白至特定的切割位點進行切割,然后通過經典的非同源性末端接合 (NHEJ) 或同源重組 (HDR) 對斷裂的DNA進行修復。然而,NHEJ修復會造成核酸的插入或者缺失(Indel), 產生顯性負效應突變或者新抗原表位的風險。雖然HDR修復度高,然而HDR修復效率極低且局限于有絲分裂細胞,限制了HDR修復的應用。因此,修復致病基因點突變依然是一大難題。
美國哈佛大學David R. Liu課題組發表在《Nature》的” Programmable editing of a target base in genomic DNA without double-stranded DNA cleavage”論文創新性的開發了基于CRISPR/Cas9的單堿基編輯器(base editor, BE),有效地解決了上述問題。
該研究組將胞嘧啶(C)轉變為尿嘧啶(U)的大鼠胞嘧啶核苷脫氨酶rAPOBEC1通過linker序列XTEN連接到催化失活Cas9(catalytically dead Cas9, dCas9)N端,構建出了代單堿基編輯器base editor (BE1)(rAPOBEC1–XTEN–dCas9)(圖一)。
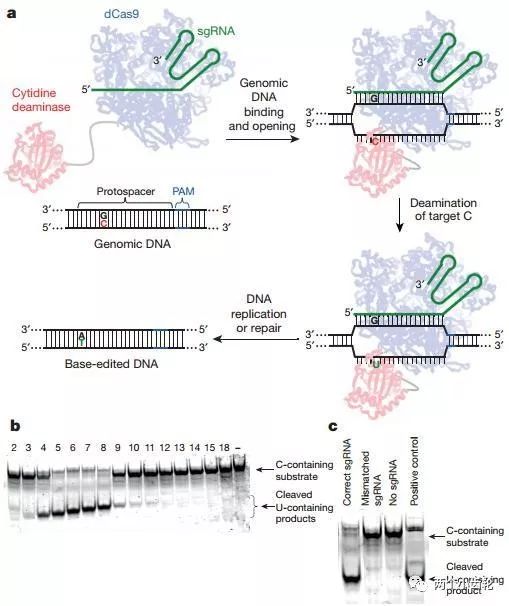
圖一
運用BE1進行體外實驗表明目標C堿基5端是G堿基時編輯效率顯著降低,BEI編輯效率遵循TC ≥ CC ≥ AC > GC (C為目標堿基)原則,此外目標C堿基位于sgRNA的第7位或者附近時編輯效率高(圖二)。體外細胞實驗研究表明,運用BE1可以使C→T的編輯效率達到0.8% - 7.7%(圖三)。

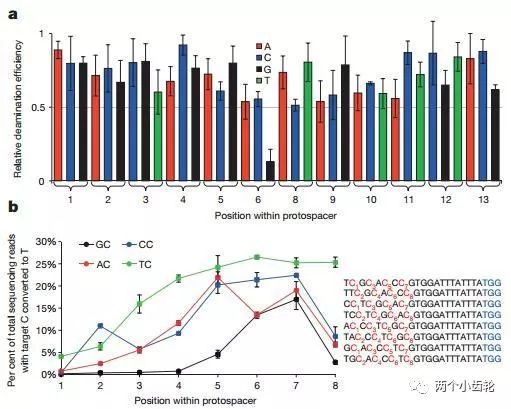
圖二
鑒于BE1的單堿基編輯效率較低,研究者們認為有可能是BE1編輯使CG堿基對轉換成UG堿基對,然而正常細胞會將UG識別為錯配堿基對,從而啟動體內尿嘧啶DNA糖基化酶(Uracil DNA glycosylase, UDG)識別U并將其切除,進而將其重新修復為CG。因此在BE1的基礎上,研究者們又融合了尿嘧啶DNA糖基化酶抑制劑(UGI),構建出了第二代單堿基編輯器BE2(rAPOBEC1–XTEN–dCas9-UGI)。實驗結果表明BE2編輯效率是BE1的3倍(圖三)。
BE2編輯過程中只改變了CG堿基對中的C堿,因此其理論上C→T的大轉換效率只能達到50%。為了進一步提高編輯效率,研究者們部分恢復BE2編輯器中Cas9的切割活性(dCas9-(A840H)),構建出了第三代單堿基編輯器BE3(rAPOBEC–XTEN–dCas9(A840H)–UGI)。BE3中的Cas9可以切割包含G堿基的非編輯DNA單鏈,斷裂后的非編輯鏈(G所在鏈)會以編輯鏈(T所在鏈)為修復模板進行修復,因此理論上C→T的轉換效率可以達到100%,即CG可以*轉換為TA。研究結果表明BE3編輯效率是BE1的2-6倍(圖三)。
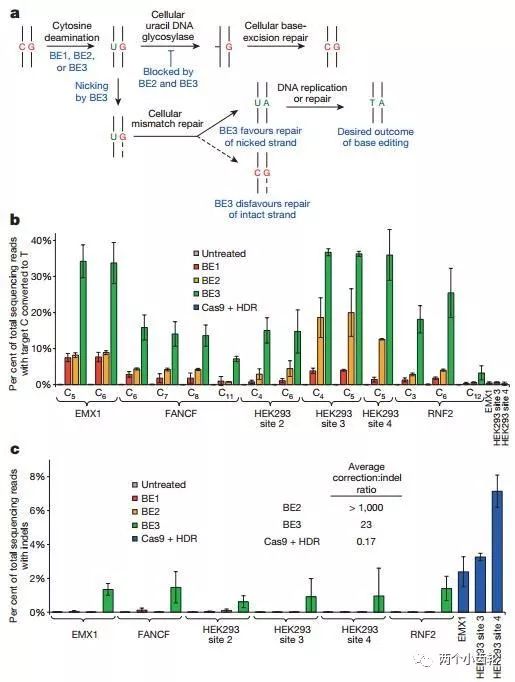
圖三
后,研究者們運用BE3對致病突變修復進行了研究。在體外細胞系的試驗發現BE3對阿爾茨海默病致病基因APOE4的改造效率可以高達74.9%,對癌癥相關致病基因TP53的改造效率為7.6%,而indel率維持在較低水平(4.6%及0.7%)(圖四)。
BE3單堿基編輯技術的出現為真正意義上的單堿基(T→C, A→G)致病突變基因的修復提供可能。
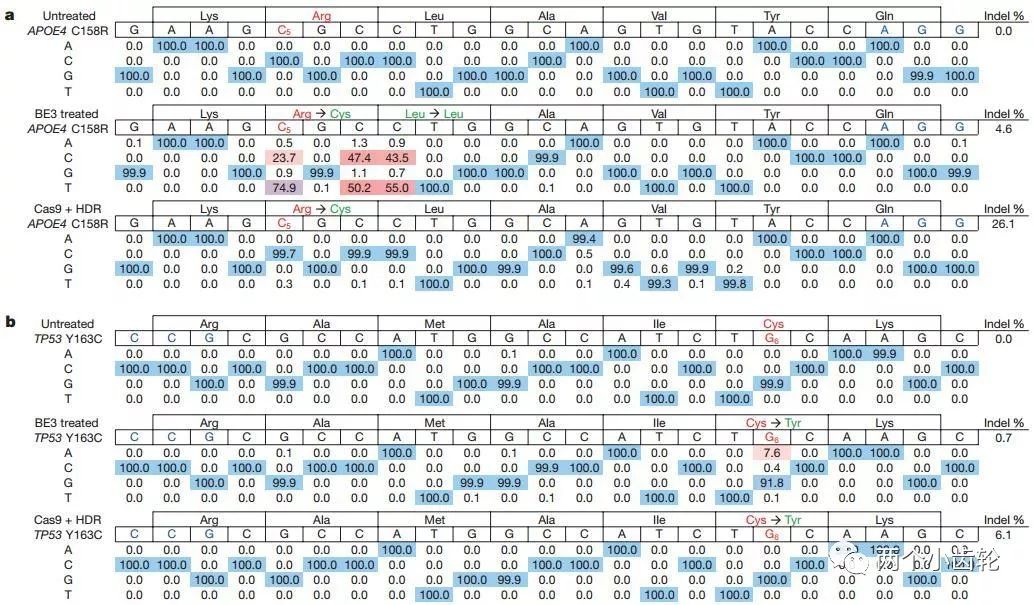
圖四
轉化醫學網
 您好, 歡迎來到化工儀器網
您好, 歡迎來到化工儀器網

 11
11


