巴氏吸管由醫用級聚乙烯(PE)制成,管體
2018年7月CRISPR/Cas研究進展
基因組編輯技術CRISPR/Cas9被《科學》雜志列為2013年年度科技進展之一,受到人們的高度重視。CRISPR是規律間隔性成簇短回文重復序列的簡稱,Cas是CRISPR相關蛋白的簡稱。CRISPR/Cas初是在細菌體內發現的,是細菌用來識別和摧毀抗噬菌體和其他病原體入侵的防御系統。
即將過去的7月份,有哪些重大的CRISPR/Cas研究或發現呢?小編梳理了一下這個月生物谷報道的CRISPR/Cas研究方面的新聞,供大家閱讀。
1.Science:治療鐮狀細胞疾病有戲!抑制蛋白激酶HRI可提高紅細胞中的胎兒血紅蛋白水平
doi:10.1126/science.aao0932
在一項新的研究中,來自美國費城兒童醫院、賓夕法尼亞大學和賓夕法尼亞州立大學的研究人員鑒定出一種調節紅細胞中的血紅蛋白產生的關鍵蛋白,從而為在未來開發出治療鐮狀細胞疾病(sickle cell disease, SCD)的創新性藥物提供了一種潛在的靶標。在體外培 養的人體細胞中進行的實驗表明阻斷這種蛋白能夠降低讓紅細胞形狀扭曲的特征性鐮刀形狀。相關研究結果發表在2018年7月20日的Science期刊上,論文標題為“Domain-focused CRISPR screen identifies HRI as a fetal hemoglobin regulator in human erythroid cells”。論文通信作者為費城兒童醫院的Gerd A. Blobel博士和賓夕法尼亞大學佩雷爾曼醫學院的Junwei Shi博士。

圖片來自Wikipedia/Illustration from Anatomy & Physiology。
導致鐮狀細胞疾病的突變存在于成人形式的血紅蛋白中,這就是這種疾病僅影響出生后的患者的原因。這種突變導致細胞呈現出異常的新月形狀,阻塞血管和損害器官,從而造成痛苦的有時甚至是危及生命的結果。血液學家早就知道相比于成人血紅蛋白,具有較高比例 的胎兒血紅蛋白的鐮狀細胞疾病患者具有較輕的癥狀。增加胎兒血紅蛋白比例的藥物羥基脲是當前的標準治療方法,但它并不適用于所有患者。因此,在這項新的研究中,這些研究人員尋求一種改進的療法。
Blobel和Shi依靠一種使用CRISPR基因編輯技術的篩選工具。Shi之前開發出這種工具來研究基因的特定功能性結構域,而不會干擾整個基因的功能。在這種特定的篩選中,這些研究人員著重關注一類包含蛋白激酶的結構域,這些蛋白激酶潛在地可通過小分子加以抑制。 這種篩選使得這些研究人員發現HRI是一種有助于抑制成人紅細胞中胎兒血紅蛋白產生的激酶。此外,通過鑒定出一種受到HRI調節的已知抑制胎兒血紅蛋白的轉錄因子,他們的研究有助認識HRI如何抑制胎兒血紅蛋白產生。當他們選擇性地移除HRI的功能時,他們提高了 紅細胞中的胎兒血紅蛋白水平。
在這些概念驗證實驗中,Blobel和Shi進一步研究了當與其他的旨在提高胎兒血紅蛋白產生的藥物聯合使用時,一種抑制HRI的候選藥物是否可能是更加有效的。這些研究人員將HRI移除與泊馬度胺(pomalidomide)處理聯合使用,其中已知泊馬度胺是一種增加胎兒血紅蛋 白產生的實驗性藥物。在細胞培養物中,聯合使用HRI移除和泊馬度胺要比單獨使用HRI移除或泊馬度胺具有更強的效果,這就支持對鐮狀細胞疾病進行聯合治療的想法。
2.Cell:利用CRISPRi技術繪制人細胞中的基因相互作用圖譜
doi:10.1016/j.cell.2018.06.010
在一項新的研究中,來自美國加州大學舊金山分校的研究人員使用一種基于CRISPR的高通量技術快速地繪制人細胞中將近500個基因的功能圖譜,其中的許多基因之前從未被詳細地研究過。相關研究結果于2018年7月19日在線發表在Cell期刊上,論文標題為“Mapping the Genetic Landscape of Human Cells”。
這項研究產生了大量新的遺傳數據,包括鑒定出參與細胞能量產生的新基因,并解釋了為何一些膽固醇藥物可用于治療骨質疏松癥而相關藥物沒有這種效果的長期謎團。但是,這些研究人員說,一個為重要的研究結果就是這項研究展示了一個用于繪制人細胞中基因功能的新框架,而且他們希望這終擴展到整個人類基因組。
在這項新研究中,Horlbeck及其同事門對之前的實驗中揭示的與細胞生長和存活相關的472個基因進行了基因相互作用圖譜分析。為此,他們使用了一種被稱作CRISPR抑制(CRISPR inhibition, CRISPRi)的工具。CRISPRi是CRISPR基因編輯系統的一個改進版本,能夠在不編輯DNA本身的情況下降低基因活性。CRISPRi是Weissman實驗室在2013年開發出來用于哺乳動物細胞中的,而且2016年,Weissman實驗室利用它破解非編碼RNA分子的功能(Science, doi:10.1126/science.aah7111)。
這些研究人員利用CRISPRi系統性地讓兩種不同白血病細胞系中的成對基因---一種細胞系代表急性淋巴細胞白血病(ALL)和另一種細胞系代表慢性髓性白血病(CML)---滅活,同時測量對細胞生長的影響。由此產生的111628個*的雙基因相互作用圖譜允許這些研究人員根據它們彼此之間的關系將472個基因分為不同的基因簇,并為這些基因簇分配功能意義,比如特定的生物通路或在細胞內的位置。
3.兩篇Cell發現噬菌體抱團抑制細菌CRISPR免疫系統,有助改進噬菌體療法
doi:10.1016/j.cell.2018.06.013; doi:10.1016/j.cell.2018.05.058
CRISPR是規律間隔性成簇短回文重復序列(clustered regularly interspaced short palindromic repeats)的簡稱。它是旨在抵御外來DNA的細菌免疫系統的一個重要的組成部分。在細菌中,CRISPR的作用就像在人體細胞中的一把剪刀一樣,切割外來的DNA鏈。盡管科學家們已知道CRISPR在野外大約一半的細菌中發現到,但他們對CRISPR與入侵的病毒或噬菌體之間的分子戰爭知之甚少。
圖片來自Mulepati, S., Bailey, S.; Astrojan/Wikipedia/ CC BY 3.0。
在2018年7月19日同時在線發表在Cell期刊上的兩篇論文中,來自兩個研究團隊的研究人員提供了當入侵含有CRISPR的細菌時,噬菌體彼此間進行合作的證據。他們發現為了壓制CRISPR的破壞,噬菌體通過聯合起來快速地感染細菌來加以適應,而且有時一個噬菌體還會為此作為引火噬菌體(primer phage)犧牲自我。這兩個研究團隊---來自美國加州大學舊金山分校和英格蘭埃克塞特大學----著重關注細菌和噬菌體之間基于CRISPR和抗CRISPR蛋白(anti-CRISPR protein)的免疫關系。這兩篇論文的標題為“Bacteriophage Cooperation Suppresses CRISPR-Cas3 and Cas9 Immunity”和“Anti-CRISPR Phages Cooperate to Overcome CRISPR-Cas Immunity”。
4.Nat Biotechnol:厄運不斷,CRISPR/Cas9基因編輯竟導致大片段DNA缺失和重排
doi:10.1038/nbt.4192
根據一項新的研究,CRISPR基因編輯工具能夠導致基因組上的靶位點附近發生大片段DNA缺失和重排。這些變化能夠干擾對實驗結果的解釋,并且可能使得設計基于CRISPR的療法的努力復雜化。相關研究結果于2018年7月17日在線發表在Nature Biotechnology期刊上,論文標題為“Repair of double-strand breaks induced by CRISPR–Cas9 leads to large deletions and complex rearrangements”。
人們經常利用CRISPR產生小片段DNA缺失,希望這樣能夠破壞一個基因的功能。但是在檢查CRISPR編輯時,Bradley和他的同事們發現了大片段DNA---通常長數千個堿基---的缺失和復雜的DNA序列重排,這些重排導致之前相隔遙遠的DNA序列被拼接在一起。這種現象在他們測試的所有三種細胞類型---小鼠胚胎干細胞、小鼠造血祖細胞和一種人分化細胞系---中都很普遍。
5.Mol Cell:揭示CRISPR/Cas9基因編輯為何有時會遭遇失敗
doi:10.1016/j.molcel.2018.06.005
在一項新的研究中,來自美國伊利諾伊大學芝加哥分校的研究人員描述了為什么CRISPR基因編輯有時無法發揮作用,以及如何讓它更加地發揮作用。相關研究結果發表在2018年7月5日的Molecular Cell期刊上,論文標題為“Enhanced Bacterial Immunity and Mammalian Genome Editing via RNA-Polymerase-Mediated Dislodging of Cas9 from Double-Strand DNA Breaks”。
在這項新的研究中,這些研究人員證實當利用CRISPR進行基因編輯遭遇失敗(大約在15%的時間發生)時,這通常是由于Cas9蛋白持續地結合到DNA上,這會阻止DNA修復酶進入切割位點。
進一步的研究表明引導Cas9僅結合到DNA雙鏈中的一條鏈會促進Cas9與RNA聚合酶之間的相互作用,從而有助于將無法發揮作用的Cas9轉化為一種的基因組編輯器。具體而言,他們發現在基因組編輯過程中,Cas9對DNA鏈的選擇保持一致性會迫使RNA聚合酶與Cas9碰撞,從而將Cas9從DNA上撞下來。
這些研究發現是非常重要的,這是因為在基因組編輯過程中,Cas9和DNA鏈之間的相互作用已知是一個“限速步驟”。這意味著它是這個基因組編輯過程中慢的部分;因此,這個步驟發生的變化有可能影響基因組編輯的總體持續時間。
6.Nature:利用CRISPR改善化療藥物甲氨蝶呤的抗癌療效
doi:10.1038/s41586-018-0316-7
作為一種經典的化療藥物,甲氨蝶呤(methotrexate)已在臨床上使用了將近70年。它的基本作用機制是*的。這種藥物抑制二氫葉酸還原酶(DHFR),其中DHFR是一種產生被稱作四氫葉酸(THF)的葉酸功能形式的酶。THF是制備核酸---比如攜帶細胞遺傳信息的DNA和參與蛋白表達的RNA---所需的原料所*的。細胞增殖必須復制它們的DNA,因此它們需要大量的THF,而且即便不發生分裂的細胞需要產生RNA,它們也需要THF。

圖片來自Lisa Nip/Whitehead Institute。
甲氨蝶呤經常被用來治療一種被稱作急性淋巴細胞白血病(ALL)的兒童白血病,而且當作為一種多層面治療計劃的一部分時,它是高度有效的。但是這是有代價的。鑒于甲氨蝶呤不僅會損害癌細胞,而且也會損害健康組織,因此必須非常小心地使用它。對接受高劑量甲氨蝶呤治療(這是針對ALL的一種主流的治療方法)的兒童患者來說,這可能意味著需要在醫院度過幾天以便接受嚴格的臨床監測。
在一項新的研究中,來自美國麻省理工學院懷特黑德生物醫學研究所的David Sabatini、Sabatini實驗室博士后研究員Naama Kanarek及其同事們開創性地利用CRISPR/Cas9基因組編輯技術篩選參與甲氨蝶呤敏感性的因素。他們取得的一組令人吃驚的發現指出組氨酸降解是癌細胞對甲氨蝶呤敏感的一種重要的決定因素。這一發現不僅有助于闡明甲氨蝶呤的生物學特性,而且也提示著一種簡單的膳食補充劑可能有助于擴大它的治療窗口和降低它的毒性。相關研究結果于2018年7月11日在線發表在Nature期刊上,論文標題為“Histidine catabolism is a major determinant of methotrexate sensitivity”。
如今,Kanarek開展的CRISPR/Cas9篩選結果進一步有助于闡明甲氨蝶呤的分子機制。她和她的同事們發現另一種被稱作FTCD的酶也參與組氨酸降解。令人關注的是,FTCD也需要THF發揮它的功能,不過不同于作為甲氨蝶呤的主要靶標的DHFR的是,FTCD并不是甲氨蝶呤的主要靶標。盡管這兩種酶對THF存在著不同的需求,但是它們都從相同的THF庫中獲取它。
在正常情形下,這個THF庫是非常充足的,因此這兩種酶不會競爭THF資源,即便是在快速分裂的細胞中,也是如此。但是當THF的數量有限---就像接受甲氨蝶呤治療的細胞中的那樣---時,情況就*不同了。就這種情形而言,FTCD的活性就存在嚴重的問題,這是因為THF庫中沒有足夠的THF來支持細胞增殖和組氨酸降解。當這種情形發生時,細胞就會死亡。
7.Science子刊:重大進展!利用叛變的癌細胞清除原發性癌癥和轉移性癌癥
doi:10.1126/scitranslmed.aao3240
假使癌細胞經重編程后能夠抵抗它們自己的同類將會怎么樣?在一項新的研究中,來自美國布萊根婦女醫院和麻省總醫院的研究人員憑借基因編輯的力量使得利用癌細胞殺死癌癥取得關鍵性的進展。他們在多種癌細胞類型的臨床前模型中報道了有希望的結果,這就為治療原發性癌癥、復發性和轉移性癌癥建立了潛在的臨床轉化路線圖。相關研究結果發表在2018年7月11日的Science Translational Medicine期刊上,論文標題為“CRISPR-enhanced engineering of therapy-sensitive cancer cells for self-targeting of primary and metastatic tumors”。
這些研究人員開發出并測試了兩種利用癌細胞的這種自我歸巢能力的技術。種技術是一種“現成的”技術,它對治療抵抗性的癌細胞進行基因改造,使得它們能夠分泌死亡受體靶向配體(death receptor–targeting ligand),這就使得它們與患者的HLA表型(本質上指的是人體的免疫指紋)相匹配,從而用于原發性癌癥臨床前模型中。第二種技術是一種“自體”方法,它利用CRISPR技術對來自患者的治療敏感性癌細胞進行基因改造,從而敲除治療特異性的細胞表面受體,隨后再次對它們進行基因改造,使得它們表達受體自我靶向配體(receptor self-targeted ligand),從而用于復發性或轉移性癌癥的自體模型中。
為了測試這兩種方法,這些研究人員使用了原發性腦癌、復發性腦癌和已擴散到大腦中的乳腺癌的小鼠模型。他們觀察到這些經過基因改造的癌細胞直接遷移到腫瘤部位,并發現了這些癌細胞特異性地靶向并殺死小鼠體內的復發性和轉移性癌癥的證據。他們報道這種治療可提高這些小鼠的存活率。此外,他們還給這些經過基因改造的癌細胞配備上一個“殺死開關(kill switch)”。這個殺死開關在治療后能夠被激活,而且PET成像表明這個殺傷開關的作用清除這些經過基因改造的癌細胞。
8.重大進展!在哺乳動物中測試充滿爭議性的CRISPR基因驅動技術
doi:10.1101/362558
一種有爭議的能夠改變整個物種基因組的技術已應用于哺乳動物中。在一項于2018年7月4日發表在bioRxiv預印本服務器上的研究中,來自美國加州大學圣地亞哥分校研究人員描述了利用CRISPR基因編輯在實驗室小鼠中開發可能*有問題的動物群體的“基因驅動(gene drive)” 技術。
基因驅動確保將經過選擇的突變傳遞給動物的幾乎所有后代。作為一種潛在的瘧疾控制策略,科學家們已在實驗室中構建出針對蚊子的基因驅動。人們已提出了這種技術有助于殺死入侵的大鼠、小鼠和其他的嚙齒類動物害蟲的可能性。這項新的研究澆滅了這種情形很快就會發生的希望。這種技術在實驗室小鼠中發揮的作用缺乏一致性,而且在人們考慮在野外使用這種工具之前,無數的技術障礙仍然存在著。
基因驅動的作用機制是確保更高比例的有機體后代確定性地而不是偶然地遺傳某種“自私”基因,從而允許突變或外源基因在群體中快速地傳播。它天然存在于包括小鼠在內的某些動物體內,這會導致它們死亡或不育。但是CRISPR-Cas9基因編輯工具已導致人們開發出合成基因驅動,比如這種合成基因驅動通過確保后代是不育的來清除野外的傳播瘧疾的蚊子等有問題的物種。
在這項新的研究中,由加利福尼亞大學圣地亞哥分校發育遺傳學家Kim Cooper領導的一個研究團隊并沒有嘗試開發讓實驗室小鼠(Mus musculus)不育的基因驅動。相反,Cooper團隊的目標是為這種技術創建一個也可能對基礎研究有用的測試平臺:它使得小鼠偏好遺傳一種導致它們產生白色毛發的突變。
基于CRISPR的基因驅動利用這種基因編輯工具將一條染色體上的突變復制到與這條染色體配對的第二條染色體上,這通常是在動物的早期發育期間開展的。當Cooper團隊在小鼠胚胎中嘗試這種方法時,這種突變并不總是被正確地復制,并且這種方法僅適用于雌性小鼠的胚胎。
Cooper團隊估計,平均而言,這可能導致一種突變傳播到大約73%的雌性小鼠的后代,而不是大多數基因依據正常的遺傳規則有50%的幾率遺傳給后代。Cooper拒絕針對她的團隊的研究工作發表評論,這是因為它迄今為止并未在同行評審的期刊上發表。
9.Nature:重大突破!無需病毒載體,利用電穿孔成功對人T細胞進行CRISPR基因編輯
doi:10.1038/s41586-018-0326-5
在一項新的研究中,來自美國加州大學舊金山分校的研究人員在不使用病毒插入DNA的情形下對人T細胞(一種免疫細胞)進行重編程。這一成就對研究、醫學和產業產生重大的影響。他們期待他們的方法---一種快速的通用的經濟的采用CRISPR基因編輯技術的方法---將會在新興的細胞治療領域中得到廣泛使用,加速開發出新的更加安全的治療癌癥、自身免疫疾病和其他疾病(包括罕見的遺傳性疾病)的療法。相關研究結果于2018年7月11日在線發表在Nature期刊上,論文標題為“Reprogramming human T cell function and specificity with non-viral genome targeting”。
圖片來自Meletios Verras/iStock。
這種新方法提供了一種強大的分子“剪切和粘貼”系統,用于重寫人T細胞中的基因組序列。它依賴于電穿孔,即一種將電場施加到細胞上使得它們的細胞膜暫時地更具有滲透性。在一年內試驗了數千個變量之后,這些研究人員發現,當某些數量的T細胞、DNA和CRISPR“剪刀”混合在一起然后暴露在一種適當的電場中時,這些T細胞將攝入DNA和CRISPR剪刀,并且地將特定的基因序列整合到CRISPR在基因組中的靶切割位點上。
論文通信作者、加州大學舊金山分校微生物學與免疫學副教授Alex Marson博士說,“這是一種快速而又靈活的方法,可用于改變、強化和重編程T細胞,這樣我們就能夠給它們提供我們想要的特異性來清除癌癥、識別感染或者抑制自身免疫性疾病中觀察到的過度免疫反應。”
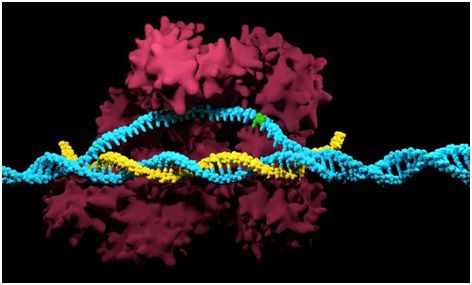
10.Science:從結構上揭示I型CRISPR-Cas系統降解靶DNA機制
doi:10.1126/science.aat0839
作為流行的CRISPR 系統,I型CRISPR-Cas的特征是有序的靶標搜索和降解。首先,多亞基監測復合物Cascade(用于抗病毒防御的CRISPR相關復合物)識別相匹配的兩側具有前間區序列鄰近基序(protospacer-adjacent motif, PAM)的雙鏈DNA靶標,促進CRISPR RNA(crRNA)和靶DNA鏈之間形成異源雙鏈體,并將非靶DNA鏈置換掉,從而導致在靶位點上形成R-環(R-loop)。隨后,將具有解螺旋酶活性和核酸酶活性的酶Cas3特異性地招募到Cascade/R-loop上并切割和漸進性地降解靶DNA鏈。來自褐色嗜熱裂孢菌(Thermobifida fusca, Tfu)的I-E型Cascade/R-loop和Cas3/單鏈DNA(ssDNA)復合物的高分辨率結構闡明了PAM識別和R-環形成機制。然而,Cas3招募、DNA切割和降解機制仍然是難以捉摸的。
在一項新的研究中,來自美國康奈爾大學和哈佛醫學院的研究人員重建出TfuCascade/R-loop/Cas3(即來自褐色嗜熱裂孢菌的Cascade/R-loop/Cas3)三元復合物,并利用單顆粒低溫電鏡技術(cryo-EM)解析出它在R-環切割前狀態和R-環切割后狀態下的結構。這些結果 為理解I型CRISPR-Cas系統中crRNA指導的DNA降解提供了結構基礎。相關研究結果發表在2018年7月6日的Science期刊上,論文標題為“Structure basis for RNA-guided DNA degradation by Cascade and Cas3”。
這些研究人員解析出TfuCascade/R-loop/Cas3在非靶DNA鏈切割前狀態下的分辨率為3.7埃的低溫電鏡圖。Cas3的結合不會引起形成R-環的Cascade復合物發生進一步構象變化,這提示著Cascade-Cas3相互作用在很大程度上是一種構象捕獲機制而不是一種誘導契合機制。 Cas3-Cascade相互作用*是由Cascade中的Cse1亞基介導的。Cas3對Cascade的識別是由于與Cascade/R-loop在電荷和表面輪廓上是互補的,但與Cascade的種泡狀態(seed-bubble state)并不是互補的。這是因為在R-環充分形成之前,Cse1的C-末端結構域處于一種替 代性方向。通過與Cse1的兩個結構域進行廣泛接觸,Cas3能夠檢測Cse1的表面輪廓發生變化,從而排斥處于這樣的功能狀態下的Cascade。有條件地將Cas3招募到Cascade上就能夠避免錯誤靶向僅具有部分互補性的DNA。
再者,這些研究人員提供了直接的證據表明一種底物移交機制對I-E型CRISPR干擾是至關重要的。Cas3的HD核酸酶結構域直接捕獲非靶DNA鏈用于鏈切割,而且這種作用*繞過了它的解旋酶結構域。這種底物捕獲依賴于非靶DNA鏈中存在的柔性凸起,而且這種切割位點偏 好性是由這種招募通路預先確定的。
這些研究人員進一步解析出TfuCascade/R-loop/Cas3在非靶DNA鏈切割后狀態下的分辨率為4.7埃的結構,這就允許他們鑒定出與這種鏈切割反應相伴隨的結構變化。這種結構揭示出由于增加的柔性,R環區域中的完整非靶DNA鏈消失了。一旦腺苷5'-三磷酸(ATP)水解, 與PAM相鄰的一半非靶DNA鏈自發地重新定位到Cas3中的解旋酶結構域的開口處。因此,在ATP水解時,Cas3的解旋酶結構域讓非靶DNA鏈通過它自身并進一步進入Cas3的HD核酸酶結構域,從而進入一種漸進性DNA降解模式。
11.Nat Commun:科學家成功將皮膚細胞重編程為多潛能干細胞
doi:10.1038/s41467-018-05067-x
我們的體內含有多種類型的細胞,每一種細胞都扮演著不同的類型的角色,2012年諾貝爾獲獎者—日本科學家山中伸彌通過研究將成體皮膚細胞成功轉化成了誘導多能干細胞(ipsC),這一過程稱之為重編程作用。
截止到目前為止,重編程過程僅可能引入關鍵的基因促進細胞類型的轉化,這種基因稱之為“山中因子”(Yamanaka factors),其能被被人工轉入到正常情況下并不具有活性的皮膚細胞中;近日,來自芬蘭赫爾辛基大學等機構的科學家們通過激活細胞自身的基因,成功將皮膚細胞轉化成了多能干細胞,相關研究刊登于雜志Nature Communications上,文章中,研究人員利用基因編輯工具CRISPRa直接對細胞中相關的基因進行了激活,他們利用了一種“鈍化”版本的Cas9剪刀,其并不會對DNA進行切割,而是能在不對基因組進行突變的基礎上來激活基因的表達。
研究者Otonkoski教授表示,CRISPR/Cas9基因編輯系統能用來激活基因的表達,其在細胞重編程上能表現出巨大的潛力,因為其在同一時間里能對多個基因進行靶向作用,相比對轉基因進行過表達作用,基于激活內源性基因的重編程過程從理論上來講能夠以一種生理學的方式來控制細胞的命運,同時還能產生較多正常的細胞;文章中,研究人員對CRISPR激活系統進行了工程化修飾,使其能夠對細胞進行強大的重編程作用以產生誘導多能干細胞。
12.兩項研究表明利用CRISPR-Cas9基因組編輯有望治療α-1抗胰蛋白酶缺乏癥
doi:10.1089/hum.2017.225; doi:10.1089/hum.2017.227
在兩項開創性的概念驗證研究中,兩個研究團隊利用CRISPR-Cas9基因組編輯技術校正導致α-1抗胰蛋白酶(alpha-1 antitrypsin, AAT)缺乏癥的基因突變,成功地在α-1抗胰蛋白酶缺乏癥(AATD)模式小鼠的肝臟中進行靶向基因校正,將低水平的正常AAT恢復到正常水平。
在項研究中,來自美國馬薩諸塞大學、中國同濟大學和武漢大學的研究人員同時注射兩種腺相關病毒(AAV)載體:一種AAV載體用于運送CRISPR-Cas9系統中的Cas9組分;另一種AAV載體編碼靶向AAT的向導RNA(gRNA)并攜帶一種同源依賴性修復模板。相關研究結果于2018年5月14日在線發表在Human Gene Therapy期刊上,論文標題為“In vivo Genome Editing Partially Restores Alpha1-Antitrypsin in a Murine Model of AAT Deficiency”。
圖片來自iStock/Meletios Verras。
在第二項研究中,來自美國Editas醫藥公司和圣路易斯大學醫學院的研究人員證實了一種基因敲降方法導致肝細胞中的有毒性的發生突變的AAT表達下降了98%以上,并且利用一種雙載體系統在靶突變位點上實現了4%~5%的核苷酸校正。相關研究結果于2018年6月22日在線發表在Human Gene Therapy期刊上,論文標題為“Amelioration of Alpha-1 Antitrypsin Deficiency Diseases with Genome Editing in Transgenic Mice”。
13.Mol Cell:封面文章解讀CRISPR-Cas系統蛋白所扮演的關鍵角色
doi:10.1016/j.molcel.2018.05.002
近日,一項刊登在雜志Molecular Cell上的研究報告中,來自喬治亞州立大學等機構的研究人員通過研究深入闡明了深入闡明了基于RNA的病毒免疫系統—CRISPR-Cas的基本生物學機制。CRISPR-Cas是細菌和古細菌能用來抵御病毒和其它外來“入侵者”的一種防御機制,當細菌被病毒攻擊時,其就能將病毒DNA“切碎”并將入侵者的一部分DNA分子片段插入細菌自身的基因組,并以這種方式來記錄病毒的DNA,隨后細菌就會利用DNA制造RNAs,并將其同細菌的蛋白相結合,殺滅病毒的DNA。
研究者Michael Terns表示,相比研究如何利用CRISPR進行治療或醫學用途而言,本文研究更多的是一項基礎性的研究成果,這項研究是適應性研究過程的特殊一步,即識別出病毒的特殊DNA序列,并將其整合到宿主的基因組中,為后代提供更多的免疫力。此前研究人員并不理解細胞如何識別病毒為外來入侵者,以及哪些細菌蛋白對于成功整合和提供免疫力是*的。這項研究中,研究人員通過研究闡明了細菌的免疫系統如何制造記憶分子來移除有害的病毒DNA序列,同時研究人員還揭示了這種特性是如何傳遞給細菌后代的。
通過分析相應的數據,研究人員發現,此前鑒別出的特征不明顯的Cas4蛋白質或許與CRISPR-Cas系統中的Cas1和Cas2蛋白存在于一定的關聯,在初的適應階段,其中一個Cas4蛋白能夠識別序列中的關鍵“信號占位符”,而這種序列距離分離的DNA序列較近。當Cas1和Cas2、以及其中一個Cas4存在于細胞中時,其就會扮演基于隊伍的免疫系統“將軍”的角色,同均一尺寸的切斷DNA序列相互“溝通”,并且決定下一步的方向,給出終摧毀致命DNA分子片段的指令。
細胞為了成功識別并且去除DNA分子片段,其就會將這些DNA分子片段的信息摻入到自身的基因組中實現免疫效力,而且Cas4蛋白必須存在于細胞中并與Cas1和Cas2串聯起來。研究者Terns說道,Cas4存在于許多CRISPR-Cas系統中,但這些蛋白質所扮演的角色研究人員卻并不清楚,在細菌的免疫系統中,有兩種關鍵的Cas4蛋白對于控制上述過程非常關鍵,因此細菌的功能性RNA需要被制造出來并且被賦予相應的免疫力。(生物谷 )
 您好, 歡迎來到化工儀器網
您好, 歡迎來到化工儀器網

 11
11


