摘要:作為抗腫瘤治療的主要手段,化療大的缺陷在于化療藥物缺乏腫瘤靶向性,易對正常組織產生高毒性,并導致治療效果不理想。為解決這一問題,越來越多的聚合物納米載體被用于遞送抗腫瘤藥物,包括對溫度刺激能作出響應的溫敏聚合物自組裝納米載體。本文綜述了近年來溫敏聚合物自組裝載體及其納米粒子的研究進展,并介紹了其在抗腫瘤藥物遞送中的應用。
1 溫敏聚合物概述
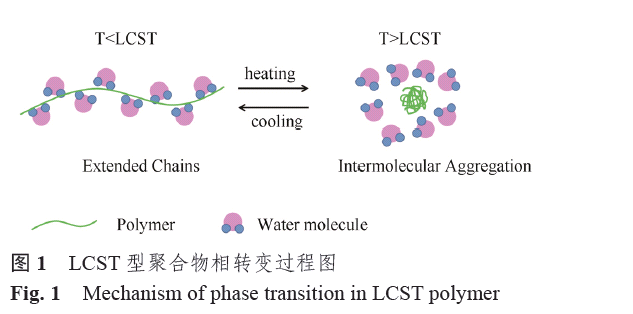
自1967 年Scarpa[3]報道了聚N-異丙基丙烯酰胺(PNIPAm)水溶液具有溫度誘導相轉變行為以來,溫敏聚合物一直受到廣泛關注。根據溫敏聚合物在不同溫度下的水中溶解度,可以將其分為2類。第1 類是當溫度高于某溫度時,聚合物水溶液呈現透明均一相,而當溫度低于該溫度時,聚合物鏈坍塌收縮,分子間聚集從水溶液中沉淀出來,發生兩相分離,此相轉變溫度被稱為*臨界共溶溫度(upper criticalsolution temperature, UCST)[4]。報道較多的UCST 體系是聚丙烯酰胺和聚丙烯酸的混合溶液,Aoki 等[5]曾利用聚丙烯酸和聚N,N-二甲基丙烯酰胺聚合物水凝膠的UCST 現象實現了對藥物可逆脈沖形式的釋放。第2 類則相反,當溫度低于某溫度時,聚合物水溶液呈現透明均一相,而當溫度高于該溫度時,聚合物鏈坍塌收縮,從水溶液中沉淀出來,發生兩相分離,此相轉變溫度被稱為極低臨界共溶溫度(lower criticalsolution temperature,LCST)[6-8]。目前大多數用于生物醫學的溫敏響應性材料是LCST 型的聚合物。具有LCST 的典型聚合物有PNIPAm[9-11]、聚N-乙烯基己內酰胺(PVCL) [12-14]、聚甲基乙烯基醚(PVME)[15]、普朗尼克(PPO-PEO-PPO)[16-18]等。PNIPAm 是目前應用多的溫敏聚合物,每年都有大量文章報道[19-20]。PNIPAm 之所以受到關注是因其LCST 在32 ℃附近,且基本不受分子量和濃度的影響。此外,PNIPAm 可通過傳統或可控自由基聚合制備,條件簡單不嚴苛[20]。另一個重要的溫敏聚合物是PVCL,其相轉變溫度在30~50 ℃之間,且該類聚合物具有生物相容性,水解后不會生成氨基衍生物,也可通過自由基聚合來制備[21]。PVME 的相變溫度在36 ℃左右,但是由于制備該類聚合物要通過陽離子聚合,條件苛刻限制了其在生物醫學上的應用[22]。PPO-PEO-PPO 作為已經商業化的產品,由于其具有臨界膠束溫度(criticalmicelle temperature,CMT即自組裝形成膠束的溫度)而被廣泛用作溫度響應性藥物遞送系統[23]。大部分PPO-PEO-PPO 的CMT介于25~40 ℃之間。LCST 型聚合物的溶解性隨溫度的升高而降低,從水溶液中析出發生相分離的過程見圖1,這一現象可由吉布斯自由能(△G=△H?T△S)來解釋。當聚合物溶于水溶液中,聚合物和水分子之間形成大量氫鍵,放出熱量,此時體系的焓變(△H)為負值,而溶解過程中水分子圍繞在聚合物溶質周圍致使體系的熵變(△S)減小(疏水效應)[24]。當整個體系處于較低溫度時,聚合物和水分子間形成的氫鍵占主導作用從而使聚合物溶解于水中,呈現均一相;隨著溫度的升高,超過LCST 時,疏水效應占主導作用,導致體系的吉布斯自由能從負值變成正值,聚合物不能再溶于水溶液中,即從水溶液中析出發生相分離[25]。
對于溫敏聚合物而言,LCST 決定了其在生物醫學上的應用,因此調節溫敏聚合物的LCST 使其滿足需求是非常重要的。將溫敏單體和其他親水或疏水性單體進行共聚來改變溫敏聚合物的LCST 是目前應用多的手段。通常而言,溫敏單體和疏水性單體共聚會使共聚物的LCST 降低,相反,若溫敏單體和親水性單體共聚則能提高共聚物的LCST[26-27]。例如NIPAm 和親水性單體N,N-二甲基丙烯酰胺(DMAAm)通過自由基聚合得到共聚P(NIPAm-co-DMAAm)。由圖2 可知,共聚物的LCST 均高于均聚物PNIPAm(32℃),且隨著共聚物中親水單體DMAAm 的比例增加,共聚物顯示出較高的LCST。

杭州新喬生物科技有限公司是國內的溫敏聚合物和共聚物生產廠家,我公司可以提供各種無機有機溫敏納米顆粒的材料。部分材料如下:
PNIPAm-b-PEG
P(NIPAM)-NHS
P4VP-NHS
P2VP-NHS
PS-PPBD Poly(styrene)-2-phenyl-2-propyl benzodithioate
PLGA-PLL
P4VP-NHS-sulfo
PAMAM-PLA-COOH
PLGA-His
mPEG-PCL-SH
PLA-PEG-MTZ
PNIPAM-b-PCL
PEG-b-PNIPAM-b-PCL
PNIPAM-b-P2VP
PNIPAM-b-P4VP
PNIPAM-b-PEA
PS-b-PNIPAM-b-PS
PNIPAM-b-PC聚碳酸酯溫敏膠束
MPEG-PC 聚乙二醇-聚碳酸酯
PNIPAM-b-PAzPy2
PNIPAM-b-PVCL
P(MAC-co-DTC)-b-PNIPAM
PNIPAM-b-PAzoM
PNIPAM-b-PZLL-b-Mpeg
PVEA-b-PNIPAM-b-PVEA
PNIPAM-b-PAA
PNIPAM-b-PtBA
PNIPAM-b-PVC-b-PNIPAM
PEO-b-PNIPAM-b-PAA
Au@PNIPAM-b-PPy
PNIPAM-b-PAzPyn
PNIPAM-b-HTPB
2 溫敏自組裝聚合物的類型及應用
2.1 聚合物膠束
聚合物膠束是由兩親性聚合物自組裝形成的具有親水外殼和疏水內核的納米粒子,可以作為
疏水性藥物的載體,具有穩定性好、可增加難溶性藥物溶解度、使藥物靶向腫瘤部位并緩慢釋放、降低不良反應、提高生物利用度等優點,是一種優良的載藥系統。近年來很多研究者設計合成了包含溫敏鏈段的嵌段共聚物并針對其自組裝形成的溫敏膠束對于抗腫瘤藥物的包載和遞送情況進行了探究。按結構來分,這些膠束大致可以分成2類,一類是以溫敏鏈段(如PNIPAm、PVCL)為疏水內核的膠束,另一類是以溫敏鏈段為親水外殼的膠束。
2.1.1以溫敏鏈段為核的膠束 以溫敏鏈段(如PNIPAm、PVCL)作為疏水內核的膠束是指由溫敏單體和親水性單體共聚得到溫敏聚合物,在低于LCST 的溫度下,該溫敏聚合物*溶于水中,在高于LCST 的溫度下,溫敏鏈段由親水變為疏水,此時的溫敏聚合物具有兩親性,能夠在水中自組裝形成膠束,并達到一定的緩釋效果。
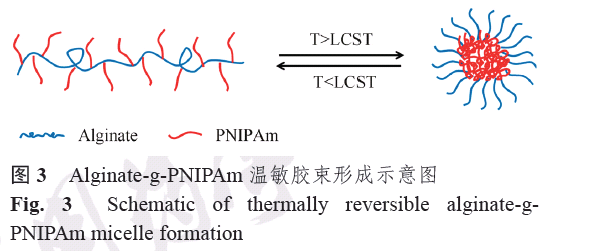
例如Ahn 等[28]利用海藻酸鈉和單端氨基化的聚N-異丙基丙烯酰胺(NH2-PNIPAm)反應得到了海藻酸鈉接枝PNIPAm 聚合物,并在37 ℃下透析制備了以溫敏鏈段為核載疏水性多柔比星的載藥膠束,見圖3,發現該載藥膠束在37 ℃下釋放較緩,96 h 后累積釋藥量才達90%。研究者采用5周的♂小鼠建立鱗狀細胞癌SCC7 皮下腫瘤模型,當腫瘤體積長至200 mm3 左右,以FCR-675 熒光染料修飾的上述海藻酸鈉-PNIPAm 膠束靜脈注射入小鼠體內,觀察48 h內小鼠模型在670 nm 紅外波長下的熒光圖像,并對主要器官和腫瘤拍攝熒光照片。如圖4 所示,游離的FCR-675 熒光染料在注入小鼠體內6 h 內有較強的信號,但隨著時間延長信號逐漸減弱;而FCR-675 修飾的海藻酸鈉-PNIPAm 膠束在腫瘤部位出現較強的近紅外熒光
信號,可見海藻酸鈉-PNIPAm 溫敏膠束由于高通透性和滯留(EPR)效應能夠被動靶向至腫瘤部位。48 h 后各主要器官和腫瘤熒光照片再次證實了海藻酸鈉-PNIPAm 溫敏膠束在腫瘤部位有大量的聚集。此外,以生理鹽水、游離DOX 為對照組,海藻酸鈉-PNIPAm 溫敏載藥膠束為實驗組,每組以尾靜脈注射給藥5 次,給藥時間為0,2,4,6,8 d,給藥劑量均為1.2 mg·kg?1 進行體內抑瘤實驗,結果顯示生理鹽水組和游離DOX 組2 周內腫瘤體積增至3 500 mm3,而海藻酸鈉-PNIPAm 溫敏載藥膠束組表現出良好的抑瘤效果,證明該溫敏膠束對多柔比星具有一定緩釋作用。
He 等[29]合成的由聚乙二醇(PEG)、聚丙烯酸(PAA) 、PNIPAm 組成的三嵌段共聚物
PEG-b-PAA-b-PNIPAm 也有類似現象,當溫度低于LCST 時,該聚合物*溶于水中,溫度高于LCST時,PNIPAm 嵌段轉變為疏水段,從而使聚合物自組裝形成以PEG 和PAA 為殼、PNIPAm 為核的溫敏膠束,并發現在25 ℃下,由于溫度低于LCST,PNIPAm 轉變成親水性致使膠束結構被破壞,10 h釋藥量已達90%,而在37 ℃下,載藥膠束10 h釋藥量為20%,120 h 后累積釋藥量僅60%,有效地實現了對多柔比星的緩釋。除了常見的以PNIPAm 作為溫敏鏈段的膠束,聚N-乙烯基己內酰胺(PVCL)也被用于制備溫敏聚合物膠束。Prabaharan 等[30]利用PVCL 的溫敏性質合成的含有葉酸(FA)的主動靶向型溫敏聚合物PVCL-b-PEG-FA 也得到了37 ℃下緩慢釋藥的結果。
2.1.2以溫敏鏈段為殼的膠束 “2.1.1”中以溫敏鏈段為核的溫敏膠束是通過溫度刺激使聚合物自組裝形成膠束,并利用膠束結構的穩定性實現其疏水核內包裹的脂溶性藥物的緩慢釋放。但是以溫敏鏈段作為疏水核限制了此類膠束包載多種脂溶性藥物的可能性,因此越來越多的研究者致力于研究以溫敏鏈段作為親水外殼的溫敏膠束。這類溫敏膠束是由一定比例的溫敏單體和疏水性單體共聚得到的聚合物在LCST 以下自組裝形成的,并利用EPR 效應被動靶向至腫瘤部位,而在LCST 以上,溫敏的親水外殼對溫度刺激作出響應轉變為疏水殼,使膠束結構發生變化從而控制藥物釋放。根據藥物釋放行為的不同可以將以溫敏鏈段為殼的溫敏膠束分成2 類,一類是溫度響應快速釋藥型膠束,另一類是溫度響應緩釋型膠束。
2.1.2.1 溫度響應快速釋藥型膠束 溫度響應快速釋藥型膠束是指當溫度高于LCST 時,溫敏親水外殼作出響應轉變為疏水殼,使膠束結構被破壞導致疏水核中藥物快速釋放的膠束。Okano 課題組[31]早報道的聚N-異丙基丙烯酰胺-b-聚甲基丙烯酸丁酯(PNIPAm-b-PBMA載多柔比星膠束,其相轉變溫度為32.5 ℃。當溫度>32.5℃時,膠束的親水殼坍塌收縮使膠束結構變形,此時該溫敏聚合物膠束表現出快速釋藥行為,而溫度<32.5 ℃時則釋藥緩慢。其體外細胞實驗也得到了一致的結果,相比于29 ℃條件下,37 ℃時載藥膠束對腫瘤細胞顯示較大的毒性。該溫敏膠束成功實現了對高于LCST的溫度刺激作出響應并快速釋放多柔比星。

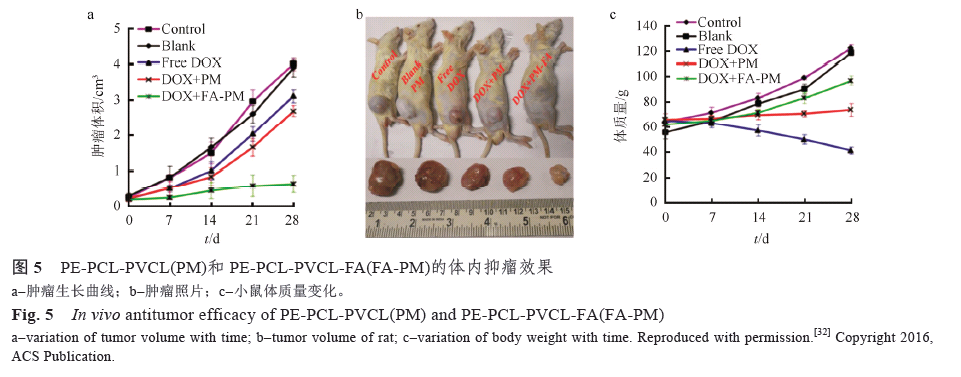
S. Chattopadhyay 課題組[32]分別利用PNIPAm和PVCL 作為溫敏鏈段,合成了2 種葉酸修飾的四臂星型嵌段溫敏聚合物PE-PCL-PNIPAm-FA 和PE-PCL-PVCL-FA,其LCST 分別為32,39 ℃。上述2 種溫敏聚合物均能在水中自組裝形成溫敏膠束,當溫度升至其LCST 以上,溫敏膠束的粒徑減小,這是由于溫敏鏈段收縮導致的。研究者利用上述溫敏膠束對DOX 進行包載發現,2 種膠束載藥量均>20%,具有較好的DOX 包載能力。體外釋放實驗發現當溫度低于LCST 時,PE-PCLPNIPAm-FA 和PE-PCL-PVCL-FA 2 種載藥膠束24 h 累積釋藥量為7.8%和9.7%,而當溫度超過LCST 時,24 h 累積釋藥量達到66.1%和78.5%,可見溫度升高促使溫敏膠束內的多柔比星快速釋放。研究者以小鼠皮下神經膠質瘤模型進行體內抑瘤實驗,分別將生理鹽水、游離DOX、空白PE-PCL-PVCL-FA 溫敏膠束、沒有葉酸修飾的PE-PCL-PVCL 載DOX 膠束和葉酸修飾的PE-PCL-PVCL-FA 載DOX 膠束5 組制劑以尾靜脈注射給藥方式注射入小鼠體內,并于注射1 h 后將小鼠腫瘤部位放入預先加熱至40 ℃的水浴中30 min。為期28 d 隔天給藥的抗腫瘤治療結果顯示游離DOX 組抑瘤率為20.2%,但是游離DOX組小鼠體質量下降嚴重,沒有葉酸修飾的PE-PCLPVCL載DOX 膠束組抑瘤率為31%,葉酸修飾的PE-PCL-PVCL-FA 載DOX 膠束抑瘤率高達83.9%,且沒有發生小鼠體質量下降現象,見圖5。
Peng 等[33]報道的P(NIPAAM-co-PEGMEA)-b-PCL 三嵌段溫敏聚合物,其LCST 為43 ℃,采用溶劑揮發法能夠制備成膠束。研究者利用該膠束對光引發劑IR-780 和熱休克蛋白抑制劑17-AAG進行了包載,并發現包載了光引發劑IR-780 的膠束在808 nm 激光下照射2 min 溫度能達到45 ℃。利用此特點,研究者對小鼠結腸癌細胞模型進行了光熱治療結合化療的體內抑瘤實驗。如圖6 所示,對照組和3 個實驗組對小鼠體質量均沒有造成較大的變化;單獨包載IR-780 或17-AAG 的膠束組相比對照組有一定抑瘤效果,同時包載了IR-780 17-AAG 的膠束組表現出比其他3 組優異的抑瘤效果,可見光熱治療促使該溫敏膠束溫度升至超過其LCST,誘導溫敏嵌段PNIPAm 坍塌,膠束結構被破壞,加速包載在膠束核內的17-AAG 釋放,從而達到了優良的抑瘤效果。

此外,還有例如Kim課題組合成的LCST接近37 ℃的聚N-異丙基丙烯酰胺-b-聚組氨酸兩嵌段溫敏聚合物(PNIPAm-b-PHis),并制備了載多柔比星膠束,見圖7a,考察了載藥膠束在不同溫度下的釋放行為。結果發現在15,25,35℃下多柔比星釋放均較慢,持續釋放60 h后釋藥量高僅30%,而當溫度升至LCST附近,或者高于LCST (45 ℃)時,釋藥速度明顯加快,60 h累積釋放量分別為60%和80%,見圖7b。細胞實驗結果顯示,在4 ℃下載藥膠束顯示較低的毒性,此時腫瘤細胞的存活率為80%左右,而當溫度升至25 ℃時細胞存活率逐漸下降,升至37 ℃時細胞存活率急劇下降,見圖7c [34]。
2.1.2.2 溫度響應緩釋型膠束 目前報道的以溫敏鏈段為殼的溫敏膠束中,絕大多數都是一類溫度響應快速釋藥膠束,但是也有不少研究者提出了不同的看法,當溫度高于LCST 時,溫敏親水外殼變成疏水層坍塌收縮在疏水核外部,這給包載在疏水核內的抗癌藥物的釋放增加了阻礙,導致藥物釋放變緩,即溫度響應緩釋型膠束。Liu 等[35]
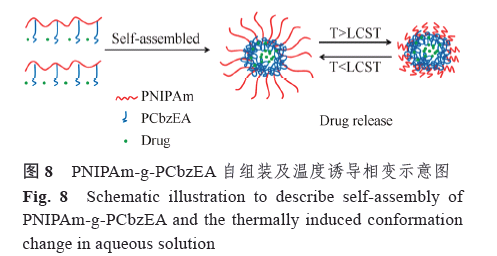
報道了LCST 為31.5 ℃的兩親性接枝共聚物聚N-異丙基丙烯酰胺-g-2-(N- 咔唑) 丙烯酸乙酯(PNIPAm-g-PCbzEA),利用透析法在低于LCST 溫度下成功制備了包載氨甲喋呤的溫敏膠束,相比低于31.5 ℃下的釋放,該膠束在高于31.5 ℃時釋藥速率較慢,釋藥量也較低,研究者認為溫度低于LCST 時,氨甲喋呤的釋放僅是從膠束的疏水內核中擴散至親水外殼再至外部介質中,但是當溫度高于LCST 時,親水外殼變成疏水層坍塌收縮在疏水核外部,這給氨甲喋呤的釋放增加了一層阻礙致使藥物釋放變緩,見圖8,利用該溫敏膠束對生理條件(37 ℃)的刺激作出響應后能延緩抗癌藥物釋放這一特點,容易實現既對正常組織產生較低毒性,又能通過EPR 效應靶向腫瘤達到抗腫瘤效果。
杭州新喬生物科技有限公司是國內的溫敏聚合物和共聚物生產廠家,我公司可以提供各種無機有機溫敏納米顆粒的材料。部分材料如下:
MPEG-b-PNIPAM-b-MPEG
PNIPAM-b-PDMS-b-PNIPAM
PHEMA-b-PNIPAM
PFS-b-PNIPAM
PNIPAm-NH2
PNIPAM-b-PNVP
PLA-b-PNIPAM聚(N-異丙基丙烯酰胺)-聚乳酸
P(NIPAM)-PAA聚(N-異丙基丙烯酰胺)-聚苯烯酸
PNIPAM-MSNs聚(N-異丙基丙烯酰胺)-介孔硅
聚(N-異丙基丙烯酰胺)-聚乙二醇PNIPAM-PEG
PS-PNIPAM 聚苯乙烯-聚(N-異丙基丙烯酰胺)
PVP-PNIPAM聚乙烯吡咯烷酮-聚(N-異丙基丙烯酰胺)
P4VP-PNIPAM聚(N-異丙基丙烯酰胺)共聚物
PEG-PNIPAM-PCL聚(N-異丙基丙烯酰胺)-光敏聚合物
PS-PNIPAM-PS
PNIPAM- b-PLGA
PMAA-b-PNIPAM,
PDMA-b-PNIPAM
(PNIPAMm-b-PNVPn)
HS-PNIPAM
PLA-b-PNIPAM
PtBA-b-PNIPAM
聚N-異丙基丙烯酰胺共聚丙烯酸PNIPAM-PAA))納米粒子
聚丙烯酸鈉-介孔二氧化硅
聚丙烯酸鈉-無機納米顆粒組裝體PAAs@INPs
Fe3O4@(PNIPAM-b-PAzoMA)納米顆粒
Chitosan-HZ-DOX 殼聚糖-腙鍵-阿霉素
P(NIPAM-AA)/Fe3O4溫敏磁性雙重響應復合微球
雙重pH敏感的聚多肽膠束載體
電荷反轉聚合物包裹納米金粒子
hy-PEI-g-PCL-b-PEG
偶氮苯修飾介孔二氧化硅顆粒
香豆素修飾介孔二氧化硅納米顆粒
刺激響應型介孔硅納米顆粒
納米閥門智能響應介孔二氧化硅顆粒
環糊精-聚乙烯亞胺包裹介孔硅顆粒
PEI-β-PEI包覆介孔硅顆粒
葫蘆脲包裹介孔硅納米顆粒
酸響應的納米閥門介孔硅顆粒
聚縮醛-納米金封堵介孔硅納米顆粒產品
聚(N-異丙基丙烯酰胺)修飾介孔硅納米顆粒
PNIPAM包裹介孔硅納米顆粒-溫度敏感
PNIPAM-b-PAA修飾介孔硅納米顆粒
ROS-溫度雙重響應三嵌段聚合物 PPS-b-PDMA-b-PNIPAAM
PPS-PNIPAm溫度和ROS雙重響應材料
PNiPAm-MSNs聚(N-異丙基丙烯酰胺)修飾介孔二氧化硅納米顆粒
PH響應共聚物PEG-b-PCL-b-PAE
p H響應的電荷可反轉的熒光嵌段聚合物MPEG5000-PU
聚ε-己內酯-聚乙烯亞胺(PCL-PEI)
聚ε-己內酯-聚乙烯亞胺-葉酸(PCL-PEI-FA)
環形聚(N-異丙基丙烯酰胺)-b-線形聚己內酯(c-PNIPAM)-b-PCL
PNIPAM-b-PCL
PNIPAM-b-PEG-COOH
PNIPAM-b-PEG-NH2
PNIPAM-b-PEG-NHS
PNIPAM-b-PEG-MAL
PAMAM-PEG-CTX
PAMAM-PEG-Angiopep
聚(N-異丙基丙烯酰胺)-b-聚(丙烯酰胺基苯硼酸),(PNIPAM-b-PAPBA)
聚(N-異丙基丙烯酰胺)-b-聚(丙烯酰葡萄糖胺), PNIPAM-b-PAGA
2.2 聚合物囊泡
聚合物囊泡是另一類由兩親性聚合物在水中自組裝形成的以疏水鏈段為夾心、親水鏈為內外
層的雙分子層納米粒子。兩親性聚合物在水中自組裝形成的結構形態取決于兩親性聚合物分子中親疏水鏈段的比例。Discher 等[36]提出,當親水鏈段體積分數在20%~42%時,可形成雙分子層結構的聚合物囊泡,隨著親水鏈段體積分數增大,自組裝體的形態可從聚合物囊泡轉變為聚合物膠束。與聚合物膠束不同的是,聚合物囊泡可同時包載親水性藥物和疏水性藥物,因此吸引了很多研究者的興趣。近年來,很多研究者將聚合物囊泡和溫度刺激響應結合起來,設計了新型的通過溫度刺激促進聚合物囊泡形成或者控制藥物釋放的溫敏聚合物。按應用來分,溫敏囊泡大致可以分成兩類,一類是對溫度刺激作出響應形成的緩釋型溫敏囊泡,另一類是溫度響應快速釋藥型囊泡。
2.2.1緩釋型溫敏囊泡 緩釋型溫敏囊泡主要是指LCST 低于生理條件37 ℃的溫敏聚合物自組裝形成的囊泡,這類溫敏聚合物在低于LCST 時能夠溶于水中,當溫度高于LCST 時溫敏鏈段變成疏水段促使聚合物自組裝形成囊泡結構,利用囊泡結構對水溶性或脂溶性的抗癌藥物進行包載從而達到緩釋的目的。例如Du 課題組[37]設計的對溫度刺激作出響應能形成囊泡的兩嵌段溫敏聚合物,聚乙二醇-b-聚N-(2-乙氧基-1,3-二氧六環)丙烯酰胺(PEO-b-PtNEA)。研究者通過PtNEA 嵌段分子量的不同來調節該聚合物的親疏水比例和相轉變溫度,合成的系列溫敏聚合物在低溫下均能溶于水中,但當溫度升高至37 ℃時PEO45-b-PtNEA172 在水中能自組裝形成囊泡結構,該囊泡結構能對親水性熒光素和疏水性多柔比星進行包載,且在37℃下多柔比星釋放緩慢,10 h 釋藥量為10%,有效實現了對多柔比星的緩釋。
Xu 等[38]選用分子量5 000 的PEO 合成的三嵌段共聚物PEO-PAA-PNIPAm,該共聚物的LCST在32 ℃左右,在溫度低于LCST 的水溶液中聚合物是*溶于水的,當溫度超過LCST 時,溫敏鏈段PNIPAm 變成疏水性從而坍塌收縮,使聚合物表現出兩親性,并能夠在水中自組裝成囊泡結構,并通過使疏水膜和外親水殼交聯得到結構更加穩定的溫敏囊泡實現緩釋藥物。
Qin 等[39]合成了一系列PEG-PNIPAm 嵌段共聚物,其中PEG 的質量分數介于7.6%~74.1%
立即詢價
您提交后,專屬客服將第一時間為您服務