Weatern blot原理
蛋白質印跡(Western Blot,WB)又稱為免疫印跡(Immunoblot),其是利用SDS聚丙烯酰胺凝膠電泳(SDS-PAGE)將樣品中分子量大小不同的蛋白分開,然后通過電轉移的方法將凝膠中的蛋白幾乎原位、定量地遷移、固定到固相膜上,再利用抗原、抗體的特異性結合反應以及特殊的抗體標記技術,進而對目的蛋白進行定性、相對定量檢測的技術。

常見問題
Q
蛋白提取后可以存放多久?
A:
蛋白提取后-80℃可保存一年。建議分裝保存,避免反復凍融。
Q
蛋白提取時用進行超聲破碎嗎?
A:
一般建議進行超聲處理,這樣可使樣本裂解更充分,對于核蛋白、核染色質相關蛋白等難提取、復雜的蛋白,超聲處理是關鍵因素。
Q
做組織樣品蛋白的WB的時候,提取蛋白
有什么特別注意的嗎?
A:
必須進行研磨、勻漿處理,做超聲處理,使蛋白質溶解度會更好,離心要充分。組織中的蛋白酶活性更強,需要加入抑制蛋白酶活性的抑制劑,防止蛋白降解。
Q
蛋白含量測定方法的選擇?
A:
提取的樣品中若含有去垢劑則需要選用BCA法進行蛋白濃度測定,若樣品中含有螯合劑(EDTA,EGTA)、還原劑(DTT,巰基乙醇)和脂類等,則需要選用Bradford法進行蛋白濃度測定。
Q
WB實驗中樣品上樣量是多少?
A:
細胞裂解物或組織勻漿的總蛋白的上樣量一般為20-40μg,純化蛋白的上樣量一般為10-100ng。
Q
WB實驗中一般需要多少個細胞?
A:
一般5×106足夠。但要看是哪種細胞,有的細胞的體積就很小,而有的細胞則鋪得很開。常規做WB一個孔道上樣要105個細胞。但也和目的蛋白及提取的方式有關。如果是膜蛋白或是某細胞器內分布的蛋白細胞數得增多。
Q
電泳后為什么會出現“微笑”或
“倒微笑”條帶?
A:
a)“微笑”是因為灌膠的時候冷卻不均勻,中間部分冷卻不好,導致凝膠中的分子有不同的遷移率所致。
b)“倒微笑”現象常常是由于垂直電泳時電泳槽的裝置不合適引起的,特別是當凝膠和玻璃板組成的三明治底部有氣泡或靠近隔片的凝膠聚合不*,加APS和TEMED后應該混合均勻。
c)電泳和轉膜溫度過高,點樣量太多或每孔點樣量不均勻,電泳電壓不穩定或過高都可能引起條帶不整齊的現象。
Q
轉膜注意事項?
A:
a)濾紙、膠、膜之間的大小,一般是濾紙≥膜≥膠。
b)濾紙、膠、膜之間千萬不能有氣泡,氣泡會造成短路。
c)保持膜的濕潤,若FVDF膜干燥,需要重新用甲醇活化。
Q
脫脂奶粉和 BSA 封閉有區別嗎?
A:
一般來講,BSA 會產生更清晰的結果,因為 BSA 含有較少的蛋白,抗體與之發生交叉反應的概率較低。但并非總是如此,有些抗體在脫脂奶粉中的封閉效果更好,因為脫脂奶粉中含有更多種類的封閉蛋白,能封閉更多不同類型的蛋白質。
Q
一抗二抗用什么稀釋?
A:
一抗可用封閉液稀釋。二抗可用TBST稀釋,若感覺背景高也可以用封閉液進行稀釋。若使用商品化的WB抗體稀釋液,則需要注意稀釋液中是否還有防腐劑(NaN3),若含有則不能稀釋HRP標記二抗。
Q
目的蛋白分子量為何與實際不符?
A:
a)翻譯后修飾:蛋白發生如磷酸化、糖基化等翻譯后修飾時分子量會增加;
b)翻譯后剪切:蛋白發生剪切時分子量會降低,某些蛋白在合成時是作為前提蛋白合成的,然后剪切形成活性形式;
c)剪切異構體:同一基因經不同剪切方式可能產生不同大小的蛋白;
d)多聚體:比如蛋白二聚化;
e)電泳,膠濃度,蛋白Marker等因素也會影響實際蛋白分子量的判斷。
Q
內參抗體的選擇?
A:
a)內參與目的蛋白分子量相差5KD以上
b)不同組織樣本在選擇內參時存在一定差別

Q
WB實驗結果條帶很弱或者無目的條帶
A:
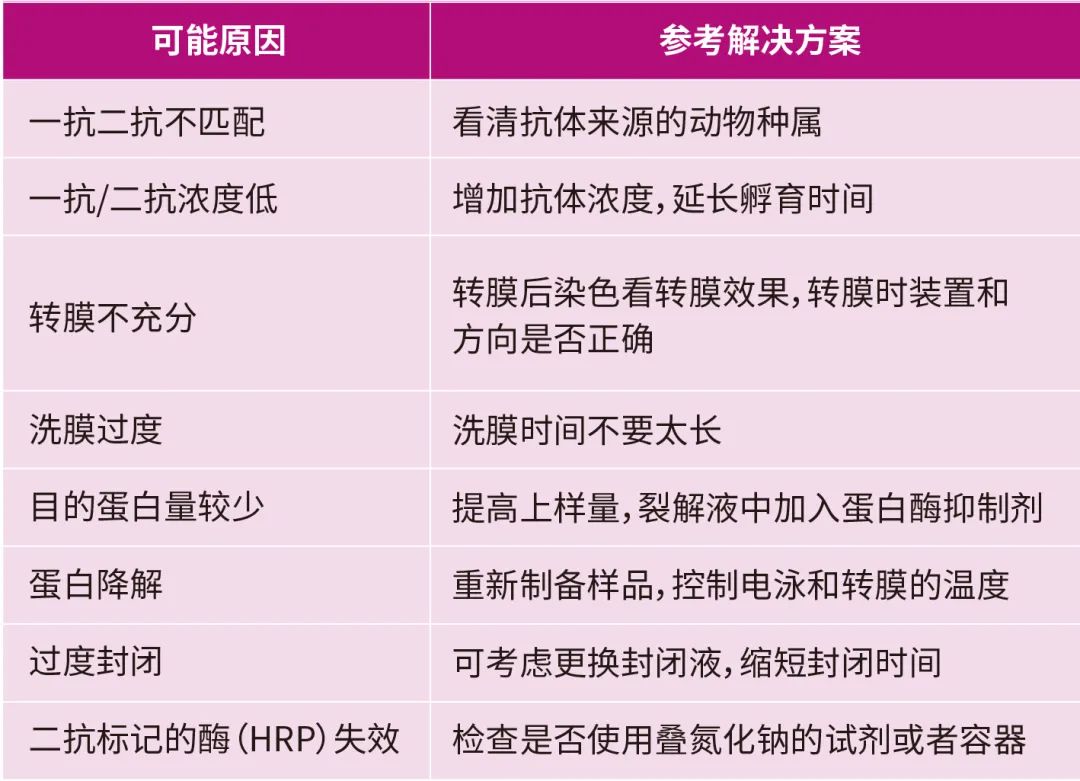
Q
WB實驗結果非特異性條帶多
A:
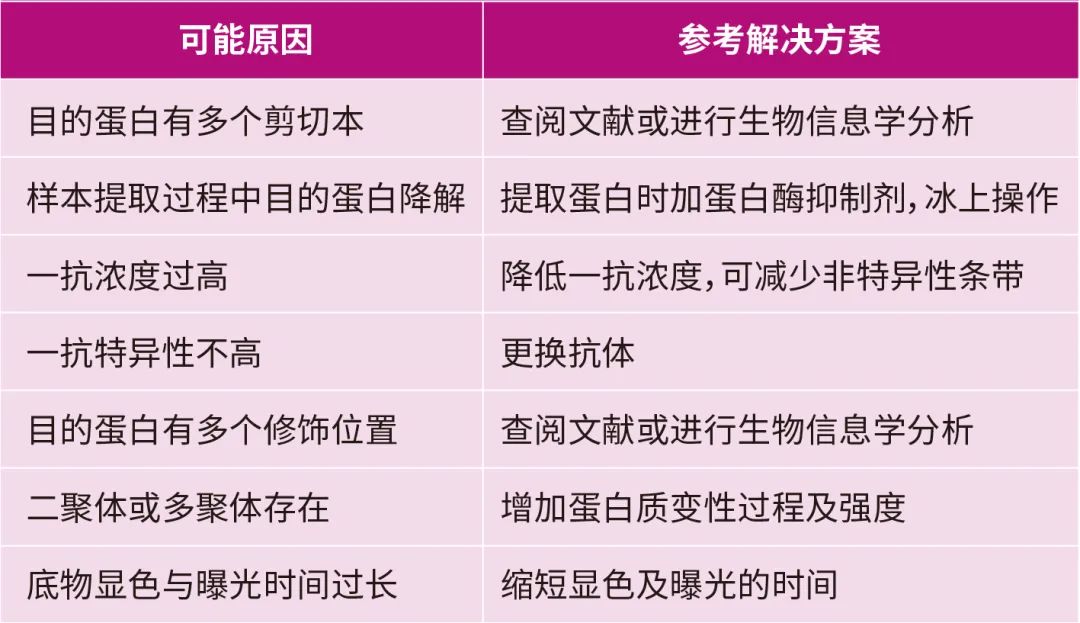
Q
WB實驗結果背景偏高
A:
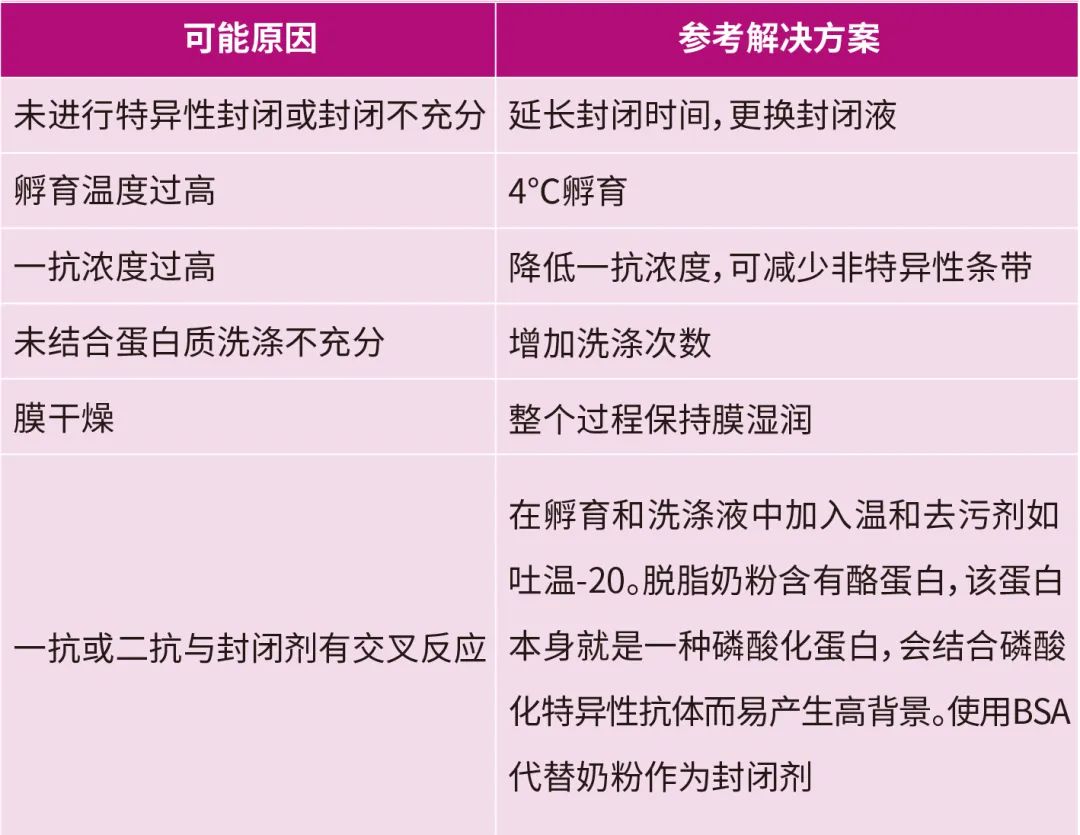
Q
WB實驗中其他常見的問題
A:

?
立即詢價
您提交后,專屬客服將第一時間為您服務