WB實驗流程
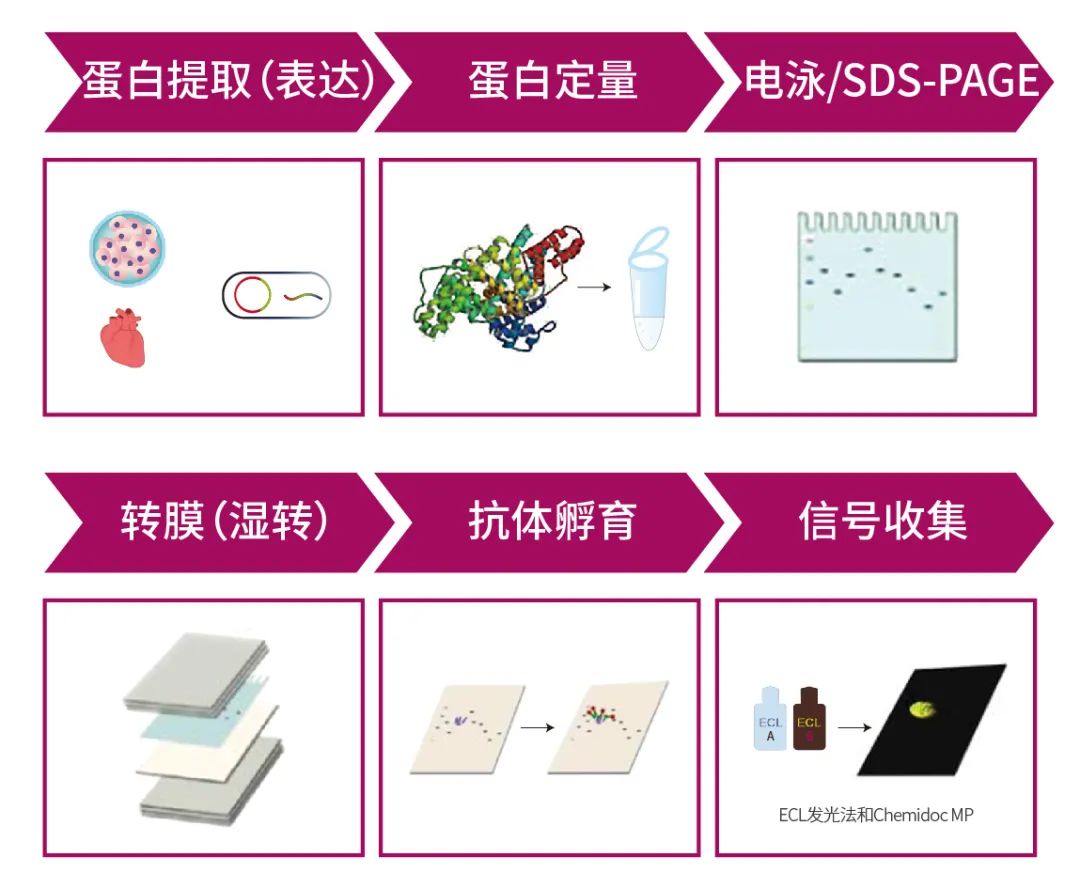
樣本制備的步驟

關于樣本采集和保存,蛋白提取的相關
知識和技巧請查看:
接下來,讓小編帶您總結關于蛋白定量和蛋白變性相關的知識點:
一
蛋白定量
測定蛋白常用的方法有Bicinchoninic acid (BCA)法、Lowry法和Bradford法(考染法)
1. BCA法的測定原理是蛋白質將銅離子還原成亞銅離子,后者在堿性溶液中與BCA結合生成紫紅色結合物,該復合物在562nm處有吸光值且與蛋白質濃度成正相關性,據此可測定蛋白質濃度。考馬斯亮藍在游離狀態下呈紅色,大光吸收在488nm;當它與蛋白質結合后變為青色,蛋白質—色素結合物在595nm波長下有大光吸收。其光吸收值與蛋白質含量成正比,因此可用于蛋白質的定量測定。
2. Lowry法又稱為Folin-酚試劑法,首先在堿性溶液中形成銅-蛋白復合物,然后這一復合物還原磷鉬酸-磷鎢酸試劑(Folin-酚上級),產生鉬藍和鎢藍復合物的深藍色,這種深藍色的復合物在745~750nm處有大的吸收峰,顏色的深淺(吸收值)與蛋白質濃度成正比,可根據750nm的光吸收值大小計算蛋白質的含量。
3. Bradford法又稱為考染法。染料結合法測定蛋白質的優點是靈敏度較高,可檢測到微量蛋白,操作簡便,試劑配制極簡單,重復性好,但干擾因素多。考馬氏亮藍G-250具有紅色和青色兩種色調、在酸性溶液中游離狀度下為棕紅色,當它通過疏水作用與蛋白質結合后,變成藍色,大吸收波長從465nm轉移到595nm處,在一定的范圍內,蛋白質含量與595nm的吸光度成正比,測定595nm處光密度值的增加即可進行蛋白質的定量。
三者之中,Lowry法與BCA同屬化學法,Lowry法是藥典中使用的蛋白濃度測定方法,但是操作繁瑣,實驗時間長。BCA法操作簡單,時間短,形成的顏色復合物穩定性強,但可能受一些雜質影響。Bradford屬于染料結合法,也易受到去垢劑影響。
二
蛋白變性
蛋白變性常用方式是高溫煮樣,煮樣條件設置為100℃,根據樣品量的多少,設置時間5~15min,煮樣時間過長,一些蛋白可能會產生聚集性沉淀。疏水性*的蛋白質,如含有多個跨膜結構域的蛋白質,在煮沸時可能會發生聚集或寡聚化,因此,其煮樣條件為40℃~55℃條件下,溫浴10~60min變性。煮樣后的樣本于-20℃或-80℃保存。
提取并定量后,并未加Loading Buffer煮樣的蛋白樣品,保存于-80℃時,防止反復凍融,并盡量于1周內加Loading Buffer煮樣處理,不要超過2周。
在此,為了幫您更好地完成實驗,我們推薦索萊寶蛋白定量和蛋白變性相關的配套產品。
產品名稱 | 產品貨號 |
Bradford法蛋白濃度測定試劑盒 | PC0010 |
BCA蛋白濃度測定試劑盒 | PC0020 |
Lowry法蛋白濃度測定試劑盒 | PC0030 |
4×蛋白上樣緩沖液 (含DTT) | P1015 |
4×蛋白上樣緩沖液 (含巰基還原劑) | P1016 |
4×非變性蛋白上樣緩沖液 | P1017 |
?
立即詢價
您提交后,專屬客服將第一時間為您服務