免疫熒光
IF是一種通過熒光基團標記檢測細胞內有機分子,胞內定位及其相互作用關系的成像研究手段。IF制劑可通過多種顯微鏡技術(如激光共聚焦、寬場熒光、全內反射成像等)來加以分析,具體取決于應用目的或研究人員的關注重點。與此同時,在很多使用至少一套簡易熒光顯微鏡的研究工作組當中,IF早已成為*的一部分。
IF實驗的核心部分是兩種不同組分的組合:
首先是特異性抗體,用于形成免疫復合物來標記細胞內需要研究的分子,大多數情況下為蛋白質。
其次是熒光色素,與免疫復合物耦合,可以利用顯微鏡進行觀察目標結構。
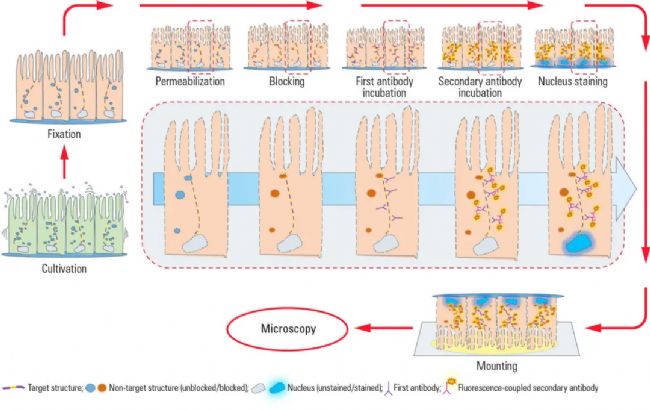
圖1:圖中顯示了間接免疫熒光的典型工作流程,上皮細胞粘附在蓋玻片上生長。培養后細胞被固定,因此用化學交聯劑(如甲醛)將其殺死。再用清潔劑進行透化處理,使抗體穿過細胞膜。用正常血清、奶粉或牛血清白蛋白來進行封閉,可減少抗體與非靶向結構的非特異性結合,從而減少假陽性信號。接下來與一抗進行孵育,特異性識別靶向分子上的表位。在第二個培育步驟中,應用熒光耦合二抗,與一抗結合來實現靶向結構的可視化觀察。抗體孵育后,用DAPI或Hoechst等嵌入DNA的染料進行細胞核染色。在顯微鏡載玻片上涂有封固介質(例如Mowiol或Prolong Gold)的蓋玻片后,IF即已準備好進行顯微鏡觀察。
直接與間接免疫熒光
根據實驗類型的不同,有兩種不同的IF變體可以使用:第一種是直接IF或一級IF,一種具有特異性的一抗,能夠與熒光色素連接用于結合靶向結構并實現直接可視化觀察。
第二種變體是指間接或二級IF,這種變體需要采用兩步式培育。首先,特異性一抗識別靶向結構。然后應用與一抗特異結合的熒光色素耦合二抗。這種特異性是通過引導二抗抵御產生一抗的物種而獲得的(見‘抗體和熒光色素’章節)。比較兩種IF變體可見兩者各有不同的優缺點:
通過耦合一抗和熒光色素,耗時的清洗和培育步驟被省略,所以直接IF比間接IF更快。因此,直接IF更易于處理,適合于在標準IF實驗中(例如在臨床實踐中)對樣本進行快速分析。但必須使用一種功能良好且對其抗原高度敏感的一抗。這同時也是一個缺點,因為熒光耦合和驗證的一抗成本較為高昂。此外,每個靶向結構都需要一個單獨的一抗,與間接IF相比,抗體與直接IF中的熒光色素的連接限制了設計實驗的靈活性。
這種靈活性是間接IF的顯著優勢之一。通常在IF反應過程中,同一樣本都會有幾個不同的靶結構需要實現可視化觀察,因此必須為每個靶向分子選擇一個離散的熒光色素。
在間接IF中,不同的熒光耦合二抗可以與不同的一抗結合(當然還要考慮到物種的反應性)。相較之下,如果想在直接IF中對靶向結構“玩"顏色組合,則需要為每一種顏色使用單獨的一抗。間接熒光的另一個優點是二抗的信號放大。多個二抗分子可與一個一抗結合來實現熒光增強,這意味可減少使用一抗。
間接IF的工作流程可能需要花費更多時間,但由于一抗和二抗能夠組合而且整個操作過程的經濟性更高,因此間接熒光成為了絕大多數研究人員的首要選擇方法。
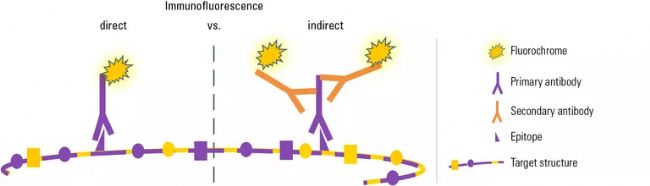
圖2:有兩種方法通過免疫熒光顯示靶向結構:在兩種變體中,一種特異的一抗用于識別靶分子上的特定表位。在此圖中,目標分子由幾個相同的蛋白質亞單位(=大分子)組成,因此會在每個亞單位上表現出幾個相同類型的表位。為方便簡化,此處只描繪了一個表位。
直接IF中,一抗直接連接到熒光色素,在顯微鏡下觀察靶向結構。間接IF中,熒光耦合二抗在第二培育步驟中使用,從而專門對一抗進行標記。因為多個二抗分子可以結合到一個一抗上,所以選擇抗體和熒光色素的靈活性更大,并能夠進一步放大信號。
抗體與熒光色素
高質量的IF染色當中,最重要的工具是良好的一抗。同時,幾乎每種細胞類型中的每種蛋白質都有一種或幾種市售抗體。但此處需要強調若干重要注意事項。
要根據IF染色來做出精確的科學或臨床聲明,就必須確保一抗對其目標抗原的特異性。在操作中,研究人員不應*依賴商業供應商的說明。應根據之前的使用經驗以及文獻中確認有效的一抗來進行抗體選擇。查看制造商網站上的抗體數據表,查看IF染色的可用圖片并與自身期望相比較,或者與其他已發布的插圖進行比較。注意抗體的克隆號,因為單克隆抗體只與一個表位特異性結合,而多克隆抗體可識別多個表位,因此有可能存在非靶向結構的非特異性標記。所以,特異性較高且性能較優的單克隆抗體通常更昂貴,但也能獲得更好的效果。
如希望開展多色間接IF實驗,則不同的一抗必須衍生自不同的物種,以便在之后通過熒光耦合二抗來區分免疫復合體(見表1)。比如,您希望使用小鼠衍生的抗體抗蛋白A、兔衍生的抗體抗蛋白B和大鼠衍生的抗體抗蛋白C來實施IF檢查。在選擇二抗時必須記住,每種抗體都只能特定識別一種一抗。此外,在這三種二抗的例子中,熒光色素的波長光譜必須不同,以便在顯微鏡分析中辨別熒光信號。如今,可以買到與熒光色素相連的二抗,其波長范圍從紫外線到紅外線,幾乎可以針對任何物種的一抗。因此,研究人員目前僅受到現有顯微鏡(濾光片組、激發激光器)配置的限制。利用新型的激光器,可以擴展紅外一區的信號(圖一、二)。
靶向蛋白質 | 蛋白質 A | 蛋白質 B | 蛋白質 C |
靶向物種 | 人類 | 人類 | 人類 |
一抗 | 抗蛋白 A | 抗蛋白 B | 抗蛋白 C |
一抗物種 反應性 | 小鼠抗人 | 兔抗人 | 大鼠抗人 |
二抗物種 反應性 | 羊抗小鼠 | 羊抗兔 | 羊抗大鼠 |
熒光色素 激發/發射 | 490/525 nm | 556/573 nm | 650/665 nm |
表1:此處的多色間接IF示例演示了如何在同一個細胞中同時標記三種不同的蛋白質。三種蛋白質的一抗必須來自不同的物種,以便用三種不同的熒光色素耦合二抗來進行檢測。二抗的熒光色素必須在波長光譜上有所區分才能在顯微鏡下進行不同的分析。
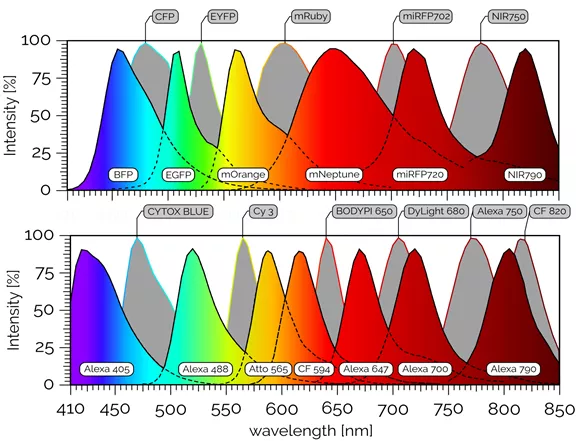
圖一 常見熒光蛋白和熒光素的發射光譜
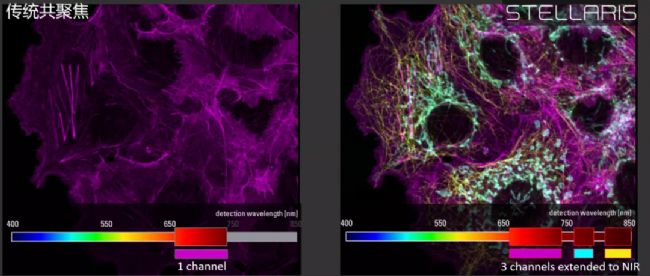
圖二 在近紅外一區,利用新型熒光標記可以獲得更多信號。Cos-7細胞圖像,使用SiR-Actin(657 – 740nm探測范圍)、AF750-Tom20(760 – 790nm)、AF790-Tubulin(810 – 850nm)標記。樣本由蘇黎世大學的Jana D?hner和Urs Ziegler提供。左:使用傳統的GaAsP探測器。右:使用STELLARIS 8。
了解了借助免疫熒光方法觀察細胞的原理,接下來獲得目標樣本并根據實驗設計合理制備用于熒光觀察的樣片。下一期將為您介紹如何為免疫熒光顯微鏡制備樣本。
今年,徠卡突破傳統免疫熒光多標數量的限制,開發了Cell DIVE超多標組織成像分析技術。通過循環染色的方法,可以實現一張組織切片,超過60個靶向蛋白的標記。從單張切片中,獲得更多的信息。
了解更多:徠卡顯微
立即詢價
您提交后,專屬客服將第一時間為您服務